За словами дослідників Массачусетського технологічного інституту, які проводили випробування нового експериментального протипухлинного препарату фенантріплатин, цей лікарський засіб показав себе більш ефективним, ніж широко використовуваний нині цисплатин. Професор Стівен Дж. Ліппард (Stephen J Lippard) з колегами припускають, що фенантриплатин не тільки краще знищує ракові клітини, він здатний також перешкодити виробленню резистентності до препаратів платини.
Хіміотерапія препаратами платини - один із найпотужніших методів боротьби з раковими захворюваннями. Цисплатин був вперше випробуваний 1978 року в США. Він ефективний насамперед щодо раку яєчка, але використовується також при лікуванні, лімфоми, раку легень, яєчника та деяких інших типів раку. Однак у цієї медалі є і зворотний бік: виражені токсичні побічні реакціїта формування пухлинними клітинами лікарської резистентності.
…базуючись на результатах останнього дослідження, учений заявив про можливість використання хіміотерапії препаратами платини щодо ширшого спектра онкозахворювань.
Ліппард вже довгий час вивчає препарати платини. Як він сам зізнався пресі, його первісне припущення щодо вузької специфічності цих ліків – хибне. Тепер же, базуючись на результатах останнього дослідження, учений заявив про можливість використання хіміотерапії препаратами платини щодо ширшого спектра онкозахворювань.
Основні переваги фенантриплатину над цисплатином такі:
- легше проникає у ракові клітини;
- інгібує транскрипцію (перший крок на шляху реалізації генетичної інформаціїклітини за допомогою перетворення ДНК на РНК).
Цитостатична дія платинових препаратів заснована на утворенні ДНК внутрішньоланцюжкових поздовжніх і поперечних зв'язків, що перешкоджають її реплікації. Це обумовлено самою хімічною структурою даних лікарських засобів: у центрі розташований атом платини, пов'язаний з двома амонієвими лігандами та двома іонами хлору. Весь цей комплекс має негативний заряд, але коли він проникає в ракову клітину, то гідролізується із заміщенням хлорид-іонів на ОН-групи та набуває позитивного заряду. ОН-групи можуть легко витіснятися, дозволяючи платиновому комплексу атакувати ДНК ракових клітин.
Раніше вважалося, що цитостатичне ефект може бути реалізований тільки при взаємодії з двома сполучними центрами ДНК, тому що це дозволяє утворювати перехресні зв'язки між ділянками ДНК. Але в 80-ті роки вчені почали досліджувати позитивно заряджені платинові комплекси, які зв'язувалися з одним центром ДНК, але також мали цитостатичним ефектом.
2008 року група вчених під керівництвом Ліппарда вивчали піриплатин. Цей препарат практично ідентичний цисплатину одним винятком: один з іонів хлору заміщений шестичленним піридиновим кільцем, що включає п'ять атомів вуглецю і один атом азоту. Однак його ефективність була нижчою, ніж у цисплатину і оксаліплатина, іншого протипухлинного засобу, схваленого Управлінням з контролю за лікарськими засобами та продуктами харчування (США) Але перша невдача не збентежила дослідників. Досліди з піриплатином навели їх на думку про доцільність використання в онкології платинових сполук з великими кільцями. На їхню думку, така особливість хімічної структури дозволить більшою мірою блокувати транскрипцію ДНК пухлинних клітин. Так, методом спроб і помилок, вони й дійшли фенантриплатину. Вчені зрозуміли, що це саме те, що вони шукали, коли фенантриплатин у пух і порох розбив цисплатин при порівнянні їх ефективності. У дослідженні використовувалося 60 типів ракових клітин, при цьому фенантриплатин був від 4 до 40 разів краще залежно від типу клітин, ніж цисплатин. Таким чином, новий препарат можна буде застосовувати у тих випадках, коли цисплатин безсилий.
Ще один важливий момент. Деякі пухлинні клітини здатні формувати стійкість до дії цисплатину. Ці клітини містять сірковмісний компонент - глутатіон, який інактивує цисплатин ще до моменту його зв'язування з ДНК. Об'ємне тричленне кільце, що входить до структури фенантриплатину, якраз і захищає платиновий комплекс від сторонньої атаки.
Тепер, після того, як препарат підтвердив свою ефективність у лабораторних дослідах, перед вченими стоїть завдання випробувати його протипухлинну дію на тваринах.
Catad_tema Пухлини жіночої статевої системи - статті
Хіміотерапія паклітакселом у поєднанні з препаратом платини порівняно із звичайною хіміотерапією препаратом платини у жінок з рецидивом раку яєчників: випробування ICON4/AGO-OVAR-2.2
Учасники випробувань ICON та AGO*
РЕЗЮМЕ
Історія питання.
Незважаючи на успіхи в лікуванні раку яєчників, у більшості хворих у межах трьох років після встановлення діагнозу розвивається рецидив захворювання. Єдиної думки щодо лікування другої лінії у разі рецидиву нині немає. Ми провели оцінку комбінації паклітакселу з препаратом платини як схему для такого лікування.
Методи.
У паралельних міжнародних багатоцентрових рандомізованих випробуваннях із січня 1996 до березня 2002 р.р. із 119 лікарень п'яти країн у випробування було включено 802 хворих із рецидивом чутливого до препаратів платини раку яєчників. Рецидив у хворих відбувся після шестимісячного періоду, протягом якого їх не проводили. Ці хворі були рандомізовані на хіміотерапію комбінацією паклітаксел/платину або на звичайну хіміотерапію препаратом платини. Аналіз, за винятком обліку токсичних ефектів, проводився по відношенню до всіх намічених для лікування хворим.
Результати.
За медіанний термін спостереження, що становив 42 місяці, померло 530 хворих. Криві виживання говорять про перевагу комбінації паклітаксел/платина (відношення ризику 0,82, р=0,02), що дає абсолютну різницю для виживання за два роки, що дорівнює 7%, між групою паклітаксел/платина і групою звичайного лікування (57 і 50 %), і різницю в медіанному виживанні, що дорівнює 5 місяцям (29 та 24 місяці). У 717 хворих відзначалася прогресія захворювання чи вони померли. Криві виживання без прогресії захворювання виявляють відмінність на користь комбінації паклітаксел/платина (відношення ризику 0,76 , р=0,0004), що відповідає абсолютній різниці для річного виживання за відсутності прогресії, що дорівнює 10% (50 і 40% ) і для різниці медіанної виживання без прогресії захворювання, що дорівнює 3 місяцям (13 і 10 місяців).
Інтерпретація.
Комбінація паклітаксел/платина дає кращу, порівняно із звичайною хіміотерапією препаратом платини, загальну виживання та виживання без прогресії захворювання серед хворих з рецидивом чутливого до препарату платини раку яєчників.
Вступ
Рак яєчників є четвертим за поширеністю раком серед жінок, що відповідає (за оціночними даними) за 114 000 летальних випадків у всьому світі на 2000 рік.1 Лікування цього захворювання протягом останніх тридцяти років покращилося за рахунок успіхів у проведенні хірургічної операції та хіміотерапії на основі препаратів платини, однак у більшості жінок з раком яєчників розвивається рецидив, і вони помирають у межах п'яти років.
Єдиної думки щодо оптимального лікування другої лінії при рецидиві захворювання відсутня, незважаючи на кілька наявних препаратів. Лікування першої лінії здійснюють шляхом хіміотерапії, заснованої на препаратах платини, причому все частіше використовують карбоплатин (у комбінації з таксаном або без нього), а не цисплатин, оскільки карбоплатин має меншу токсичність при однаковій активності. хіміотерапію, засновану на препараті платини, залежить від тривалості періоду, протягом якого препарат платини не застосовувався. . Жінки, захворювання яких прогресувало в умовах вихідного лікування препаратом платини, а також ті, у яких рецидив розвивається в межах шести місяців після вихідного лікування препаратом платини, рідко відповідають на продовження лікування препаратом платини та вважаються такими, що мають захворювання, резистентне до платини. Для таких хворих як активний лікарський препарат і був вперше запропонований паклітаксел.5 Цей препарат зазвичай добре переноситься, найбільш частими побічними ефектами є алопеція, мієлосупресія та нейропатія.
У більшості хворих захворювання не є резистентним до платини, проте в межах шести місяців або більш тривалого терміну після лікування першої лінії у них розвивається рецидив. для цих хворих (при використанні в поєднанні з платиною) більшою мірою, ніж повторення звичайної схеми хіміотерапії на основі платини. У дослідженнях на хворих з рецидивами захворювання, чутливого до платини, після застосування комбінації карбоплатин/паклітаксел відповідь становила до 90%. хворих на рак яєчників, що дають рецидив через шість або більше місяців після хіміотерапії. У рандомізованих випробуваннях ICON4 та AGO-OVAR-2.2 ми порушили питання про ефективність комбінації паклітаксел/платина у хворих з раніше лікованим раком яєчників. Наше завдання полягало в тому, щоб з'ясувати, чи слід додавати паклітаксел до препарату платини для лікування хворих із захворюванням, чутливим до платини, і яких інакше лікували б звичайними схемами на основі препарату платини.
Хворі та методи
Випробування ICON4 та AGO-OVAR-2.2 проводилися як паралельні випробування.
Випробування ICON4 координувалося Інститутом Маріо Негрі (Мілан, Італія) (IRFMN) та Відділом клінічних випробувань Ради з медичних досліджень (Лондон, Великобританія) (MRC CTU). Випробування AGO-OVAR-2.2 координувалося AGO (Карлсруе, Німеччина).
Хворі
Хворих набирали у випробування у період із січня 1996 року до березня 2002 року зі 119 лікарень у п'яти країнах. Хворих направляли однією із трьох протоколів; один із них був координований MRC CTU для лікарень Великобританії, Норвегії та Швейцарії; один був координований IRFMN для Італії, і один проводився під егідою AGO. Критерії для включення хворих у випробування були наступними: рецидивуючий епітеліальний рак яєчників, що вимагав хіміотерапії; хіміотерапія, що раніше проводилася, з використанням препарату платини; відсутність лікування протягом терміну, що перевищував 6 місяців (>12 місяців для групи ICON4 в Італії); відсутність одночасного або виниклого раніше злоякісного захворювання, Який може вплинути на лікування або його результати; отримана після інформування письмова згода хворої на участь у випробуванні.
Критерії, яким повинні були задовольняти хворі для участі у випробуванні, трохи відрізнялися для трьох протоколів. За протоколом MRC CTU хворим у минулому могла проводитися більш ніж одна лінія хіміотерапії, тоді як хворим, рандомізованим відповідно до італійського протоколу AGO, дозволялося мати лише одну попередню лінію хіміотерапії. Для хворих, рандомізованих відповідно до італійських протоколів, була потрібна наявність вимірюваної пухлини; ця вимога була відсутня для протоколів MRC CTU або AGO. Діагноз рецидиву захворювання на момент включення у випробування у 18 хворих за протоколом MRC CTU був заснований на підвищеному рівні СА125. Хворі, рандомізовані на протокол AGO, мали раніше лікуватися на схемі цисплатин/паклітаксел або карбоплатин/паклітаксел; у випробуванні ICON4 потрібно, щоб хворі пройшли попередню хіміотерапію препаратом платини з паклітакселом або без нього.
Методи
Хворих, рандомізували на звичайну хіміотерапію препаратом платини або на аналогічну дозу препарату платини з паклітакселом, причому лікування починали можливо більше стислі термінипісля рандомізації. Відповідно до всіх протоколів курси лікування проводилися раз на три тижні. Відповідно до протоколу MRC CTU, кожній хворій слід було провести принаймні шість курсів. За італійським протоколом, хворим призначалося принаймні три курси, а подальші три курси призначалися в залежності від відповіді на лікування. За протоколом AGO, хворим призначалося щонайменше шість курсів та максимум вісім курсів лікування, оцінка відповіді на лікування проводилася після другого та четвертого курсів. Усі препарати вводилися внутрішньовенно першого дня кожного з курсів. Дозу карбоплатину визначали за допомогою методу площі під кривою (AUC), описаного Кальвертом з співавт.9, і вона становила, як мінімум, 5 (СГФ+25) мг, де СГФ являє собою СГФ, що визначалася радіоізотопним методом або шляхом добової сечі. Якщо швидкість гломерулярної фільтрації визначали за формулою Кокрофта, доза карбоплатину становила щонайменше 6 (СГФ+25) мг. Запланована мінімальна доза цисплатину тільки для хворих на випробування ICON4 становила 75 мг/м2 при введенні цисплатину як єдиний препарат, і 50 мг/м2, коли його вводили в комбінації з іншими препаратами. Хворі у випробуванні ICON4, призначені на лікування комбінацією паклітаксел/платину, повинні були отримувати паклітаксел у дозі 175 мг/м2 шляхом 3-годинного вливання з подальшим вливанням карбоплатину або цисплатину у вищезгаданій дозі. Хворі в протоколі AGO, призначені в групу лікування паклітакселом/карбоплатином, повинні були отримувати паклітаксел у дозі 185 мг/м2 у формі 3-годинного вливання з подальшим вливанням карбоплатину в дозі, зазначеній вище.
Рандомізацію для трьох протоколів проводили незалежно. Про всіх хворих збирали однакову інформацію. Ставлення рандомізації між групами лікування становило 1:1. Для рандомізації, що виконувалася телефоном або факсом, використовували метод мінімізації на комп'ютері. У двох протоколах випробування ICON4 (MRC CTU та італійський) стратифікація проводилася щодо одних і тих же факторів, а саме установи, віку хворого, останньої хіміотерапії, що проводилася, часу після завершення останньої хіміотерапії і запланованого лікування препаратом платини. Запланована схема лікування препаратом платини мала бути визначена до рандомізації. У протоколі AGO стратифікацію проводили щодо часу після завершення останньої хіміотерапії, а також щодо того, проводилася або не проводилася хвора друга операція циторедукції (зменшення маси пухлини).
Для випробування ICON4 було створено незалежний комітет з моніторингу даних та етики, що складався з двох клініцистів та одного статистика, не пов'язаних із випробуванням. Хід випробування та його незакриті результати, а також всі інші важливі зовнішні дані розглядалися орієнтовно щорічно протягом періоду запису хворих на випробування. Комітет не дотримувався заздалегідь визначених статистичних правил для зупинення. Для випробування AGO, комітет з моніторингу даних та етики не створювали, але протокол рецензувався і приймався місцевими комітетами з етики кожного з центрів, що брали участь.
Дані, які стосуються періоду до лікування, збирали під час рандомізації.
Дані про лікування збирали для кожного курсу. Дані наступних обстежень збирали раз на три місяці протягом перших двох років та раз на шість місяців надалі. Для збору даних цих обстежень ми використовували односторінковий формуляр, що містить питання щодо захворювання, життєвого статусу, симптоматики, побічних ефектів та лікування після останнього звіту. Всі ці дані збиралися, перевірялися та зберігалися в електронному вигляді групами, які брали участь у випробуванні.
Дані про якість життя збирали для всіх хворих, які лікувалися за протоколом MRC CTU та AGO. Ми використовували анкету про якість життя QLQ-C30 (версія 2.0), розроблену Європейською організацією з дослідження та лікування раку (EORTC). Хворі, які лікувалися за протоколом MRC CTU, заповнювали анкету вихідно, перед кожним курсом лікування за протоколом, а також під час візитів через 6, 9 та 12 місяців. Хворі, які отримували лікування за протоколом AGO, заповнювали анкету вихідно, перед другим та третім курсами лікування за протоколом, наприкінці лікування за протоколом та раз на три місяці протягом року після завершення лікування за протоколом.
Ми здійснили кілька аналізів для підгруп. Критерії для підгруп включали групу рандомізації, час після завершення останньої хіміотерапії, кількість попередніх ліній хіміотерапії, що проводилося раніше лікування таксанами, препарат платини, запланований для лікування, вік та функціональний статус.
Статистичний аналіз
Головним обліковим критерієм була загальна виживання; вторинними критеріями були виживання без прогресії захворювання та якість життя. Коли проводилися розрахунки розмірів вихідної вибірки, були лише нечисленні дані щодо результату рецидивуючого раку яєчників. Ми очікували, що дворічне виживання становитиме близько 5% для контрольної групи, а абсолютні відмінності у виживанні за два роки не перевищуватимуть 5-10%.
Усього ми запланували для випробування 800 хворих, щоб впевнене виявити абсолютні відмінності у виживання за два роки, що становлять 5% (5-10%) з впевненістю 95% при рівні достовірності 5%; це відповідає відношенню ризику 0,77. На завершальному засіданні 8 лютого 2001 року Комітет з моніторингу даних та етики зазначив, що виживання у контрольній групі було значно вищим, ніж при вихідних розрахунках впевненості. Дворічне виживання у групі, де проводилося звичайне лікування, становило 50%. Тому ми переглянули це питання. Ми розрахували, що 800 хворих буде достатньо для надійної ідентифікації абсолютних відмінностей, що становлять 11% для виживання за два роки (50-61%) з ймовірністю 90% при рівні достовірності 5%, що дає відношення ризику 0,71. Тому запланована для випробування кількість хворих залишилася без змін.
Ми порівняли криві Каплана-Мейєра для загальної виживання та виживання без прогресії захворювання з варіантом лог-рангового критерію Мантел-Кокса при стратифікації на три групи рандомізації. Загальне виживання визначалося час від часу рандомізації до летального результату від будь-якої причини; хворі, про які було відомо, що вони живі на момент аналізу, враховували на момент останнього обстеження. Ми визначили час виживання без прогресії захворювання як час від моменту рандомізації до першого прояву прогресії захворювання або смерті від будь-якої з причин; хворі, про які було відомо, що вони живі та не мають ознак прогресії захворювання на момент аналізу, враховували на момент проведення останнього обстеження. Саме собою підвищення концентрації СА125, тобто.
підвищення за відсутності клінічних чи радіологічних ознак прогресуючого захворювання, не вважалося вказівкою на прогресію захворювання. Абсолютна перевага на конкретний момент часу розраховувалося за виживанням, оціненим у контрольній групі за Капланом-Мейєром на цей момент часу (виживання в контролі) та відношенню ризику з використанням наступного виразу: абсолютна перевага = exp (відношення ризику х log [виживання в контролі]) - Виживання у контролі.
Той самий підхід було прийнято для виживання без прогресії захворювання. Хоча такий підхід побічно передбачає наявність пропорційних ризиків, він є кращим ніж облік відмінностей між кривими за Капланом-Мейєром в індивідуальні моменти часу. Ми розраховували відмінності щодо медіан аналогічним чином, однак, з використанням виразу: різниця медіан = (медіана контролю/відношення ризику) – медіана контролю. Цей підхід виходить з того, що значення часу виживання мають приблизно експоненційний розподіл.
Ми оцінили відносні переваги хіміотерапії препаратами платини для виживання в дослідному порядку в підгрупах, визначених на основі групи рандомізації, часу після завершення останньої хіміотерапії, числа попередніх ліній хіміотерапії, що передував таксанів, препарату платини, запланованого для лікування, тобто. карбоплатину або цисплатину, віку та функціонального статусу. Для того, щоб оцінити відмінності у відносній величині ефекту для різних підгруп, ми використовували критерій 2 для взаємодії або, у випадках, коли це було можливо, критерій 2 для тренду.
Для аналізу даних щодо якості життя, як це було рекомендовано, ми використовували п'ять функціональних шкал (фізичну, рольову, емоційну, когнітивну та соціальну), дев'ять шкал симптоматики (почуття втоми, нудота та блювання, болі, задишка, безсоння, втрата апетиту, запор , пронос і фінансові труднощі), а також загальний статусздоров'я. З урахуванням характеру раку яєчників нас особливо цікавили почуття втоми, нудота/блювота та больова симптоматика, а також загальний (глобальний) стан здоров'я як загальний критерій. Для кожного критерію ми аналізували два набори сумарних статистичних параметрів: найгірший бал і площа під кривою за перші шість місяців.11 Для аналізу використовувався непараметричний критерій Манна-Уітні. порівнянь).
Аналізи проводилися всім хворих, включених у випробування (в англомовної літературі - критерій " намір лікувати " ), крім аналізу токсичних ефектів. Аналізи щодо токсичних ефектів обмежувалися хворими, які отримали принаймні один курс призначеного лікування. Усі значення р є двосторонніми. Аналіз було здійснено за допомогою пакета SAS (версія 8.20).
Роль джерела фінансування
Спонсори випробування не відігравали ролі у плануванні випробування, збиранні даних, аналізі даних, інтерпретації даних або написанні звіту.
Результати
У випробування було включено 802 хворих. Тривалість періоду надходження хворих на випробування варіював для трьох протоколів: для італійської групи ICON4 - з січня 1996 по березень 2002; для групи MRC CTU ICON4 – з травня 1996 до березня 2002 р.р., і для AGO – з жовтня 1996 до вересня 1999 р.р. Чотириста десять хворих було включено до групи, яка отримувала звичайну хіміотерапію на основі препаратів платини, та 392 хворих до групи паклітаксел/платина (Рис. 1).
Характеристики до лікування були однаковими обох груп (Таблиця 1).
Типи одержаного лікування вказані в Таблиці 2. 580 хворих (72%) в обох групах лікування отримали щонайменше шість курсів хіміотерапії (Рис. 1). Причини незавершення шести курсів лікування включали наступне: прогресія захворювання або летальний кінець (109), токсичні ефекти під час лікування 77) та бажання хворої (9). Лише троє хворих не отримали призначеної хіміотерапії (Рис. 1). 123 (41%) із 300 хворих у групі, що отримувала звичайне лікування, та 129 (40%) із 322 хворих, які отримували лікування паклітакселом та карбоплатином, отримали більше 90% запланованої загальної дози, а 54 (18%) із 300 хворих та 76 (23%) з 330 хворих відповідно отримали більше 90% загальної дози карбоплатину. Відповідні цифри для паклітакселу в групі, що отримувала паклітаксел/карбоплатин, становили 266 (71%) із 376 хворих щодо загальної дози та 160 (43%) із 376 щодо загальної інтенсивності дози.
У Таблиці 3 наведено частку хворих, у яких під час лікування відзначався помірний чи тяжкий побічний ефект. Як і можна було очікувати, комбінація паклітаксел/платина давала вищий відсоток алопеції порівняно із звичайною хіміотерапією препаратом платини. Відсоток токсичних ефектів помірного або тяжкого ступеня щодо кровотворення був більш високим серед хворих, які отримували звичайну хіміотерапію препаратом платини, порівняно з групою, де лікування проводилося комбінацією паклітаксел/платину. Помірні або тяжкі неврологічні токсичні ефекти відзначалися у 76 (20%) хворих, які отримували комбінацію паклітаксел/платину. Інші токсичні ефекти рідкісні в обох групах лікування.
До березня 2003 року (середній медіанний час спостереження 42 місяці) померли 530 хворих (66%). Криві виживання відповідають відношенню ризику 0,82 (95% ДІ 0,69-0,97, р=0,02; Рис. 2), що відповідає абсолютній різниці у дворічній виживаності, що становить 7% на користь хіміотерапії комбінацією паклітаксел/препарат порівняно із звичайним лікуванням (57 і 50%). Для медіанного виживання відношення ризику відповідає різниці, що дорівнює 5 місяцям (29 та 24 місяці). У 717 хворих (89%) розвинулося прогресуюче захворювання або вони померли. Криві виживання без прогресії захворювання, наведені на Рис. 3. Відношення ризику, що становить 0,76 (0,66-0,89, р=0004) на користь схеми паклітаксел/препарат платини, відповідає оцінній абсолютній різниці значень річного виживання без прогресії захворювання, що становить 10% (40 і 50%) . Цей результат відповідає абсолютній різниці для медіанного виживання без ознак прогресії захворювання, що становить 3 місяці на користь схеми паклітаксел/препарат платини (9 та 12 місяців).
У 69 (54%) із 128 хворих у групі, яка отримувала звичайну хіміотерапію, спостерігалася повна або часткова відповідь на лікування, порівняно з 78 (66%) із 119 хворих у групі, яка отримувала схему паклітаксел/препарат платини.
Відповідно, відповідь на лікування є кращою для групи паклітаксел/препарат платини (різниця 12% [-0,1% до 24%], р=0,06). Ми не відзначили будь-яких чітких ознак того, що схема паклітаксел/платина була більш ефективною або менш ефективною порівняно із звичайною хіміотерапією препаратом платини для будь-якої з підгруп за критеріями загального виживання або виживання без ознак прогресії захворювання (Рис. 4 і 5).
Деталі лікування, що проводилося під час прогресії захворювання, були для 437 із 536 хворих. Усього 70 (31%) хворих у звичайній групі лікування отримували при прогресії лікування на основі препаратів таксану. У групі, яка отримувала комбінацію паклітаксел/платини, 16 (8%) хворих продовжували отримувати при прогресії подальше лікування схемою на основі таксану.
У групі, що використовувала протокол MRC CTU ICON4, 482 (90%) з 536 хворих заповнили анкету з оцінки якості життя до початку лікування. Усі шкали двох груп лікування були збалансованими. Більшість хворих не мали функціональних труднощів або вони були незначні, кількість симптомів помірної або великої тяжкості невелика. Протягом перших шести місяців після рандомізації значення найгіршого балу та площ під кривими не відрізнялися для двох груп лікування за всіма п'ятьма функціональними шкалами, восьми з дев'яти шкалами симптоматики та за глобальним статусом здоров'я. Єдиним винятком була нудота і блювота, яка була тяжчою для хворих, які отримували звичайну хіміотерапію (р=0,0014 для найгіршого балу, р=0,005 для площі під кривою). Рис. 6 наведено значення балу в часі для трьох симптомів, найбільш типових для раку яєчників – почуття втоми, нудоти та блювання, а також для болю та глобального статусу здоров'я. Для глобального статусу здоров'я відзначалося незначне зниження частки хворих, що визначаються як такі, що мають погане самопочуття або дуже низький статус здоров'я протягом перших шести місяців. Аналогічна тенденція відзначалася почуття втоми. Навпаки, больова симптоматика обох групах повертається до значень, притаманним періоду до лікування.
Хоча є певні вказівки на відмінності за нудотою та блюванням на користь групи, яка отримувала паклітаксел/платина, такі відмінності мають тимчасовий характер, відносячись лише до перших 15 тижнів.
Обговорення
З урахуванням даних щодо виживання без прогресії захворювання та загальної виживання, у нашому випробуванні досить кількість хворих вижила і перебувала в групі ризику на 4-річний термін, щоб зробити висновок про те, що загальні результатицей термін є надійними. Дев'яносто відсотків хворих було рандомізовано після першого рецидиву, а 75% через 12 місяців після завершення хіміотерапії препаратом платини. Вважається, такі хворі мають розумний прогноз. Та обставина, що наше випробування є великомасштабним, дозволило нам проаналізувати підгрупи з метою оцінки того, наскільки однотипним є ефект комбінації паклітаксел/платина. Тим не менш, багато підгруп невеликі за чисельністю і тому можливість виявлення реальних відмінностей невелика. Але, як би там не було, хороші дані на користь більшого ефекту або меншого ефекту комбінації паклітаксел/платини порівняно із звичайним лікуванням у будь-якій підгрупі відсутні. Величина ефекту комбінації паклітаксел/платина близька для різних груп рандомізації, незважаючи на відмінності в умовах, використаних для включення хворих у випробування, та фактори стратифікації. Далі немає вказівок на те, що ефект комбінації паклітаксел/платина відрізнявся для хворих, які отримували таксани як складову частину лікування першої лінії (близько 40% загальної кількості рандомізованих хворих) і тих хворих, які таксани не отримували.
Паклітаксел як індивідуальний препарат порівнювався з циклофосфамідом, доксорубіцином і цисплатином (схема САР) серед хворих, які дали відповідь на хіміотерапію першої лінії препаратом платини, проте захворювання у яких рецидивувало після більш ніж 12-місячного періоду відсутності лікування.13 У випробуванні, про яке йдеться мова, у 97 хворих з оцінюваним захворюванням монотерапія паклітакселом давала медіанний термін без прогресії захворювання, що становив 9 місяців, порівняно з 15,7 місяцями для схеми САР (відношення ризику 0,69). Середня загальна виживання становила 25,8 місяці для монотерапії паклітакселом та 34,7 місяця для схеми САР (0,58). Хоча кількість хворих недостатньо велика, щоб зробити остаточні висновки, ці результати дозволяють вважати, що хіміотерапія на основі препарату платини є важливим компонентом хіміотерапії при рецидиві, якщо захворювання залишається чутливим до платини.
Наші результати вказують на адитивний ефект платини та паклітакселу.
Подібні дані були зазначені в ряді випробувань першої лінії (комбінація циклофосфамід 750 мг/м2 у поєднанні з цисплатином 75 мг/м2 використовувалася у випробуванні групи GOG-11114 та у випробуванні OV1015), але не в інших випробуваннях (монотерапія цисплатином у дозі м2, випробування GOG-13216 та карбоплатин з мінімальним значенням до AUC 5 або комбінація циклофосфаміду 500 мг/м2, доксорубіцину 20 мг/м2 та цисплатину 50 мг/м2, що використовувалась у випробуванні ICON36)17. Результати випробувань ICON3 та GOG-132 відрізняються від позитивного результату , зазначеного у нашому випробуванні, в якому 85% хворих у групі паклітаксел/платину отримували комбінацію карбоплатину та паклітакселу. Проте досліджені контингенти хворих на групу досить різні. Жінки в нашому дослідженні можуть вважатися такими, що мають чутливе до платини захворювання і мають високу ймовірність відповіді на подальше призначення препарату платини, проте їх захворювання, ймовірно, менш чутливе до платини, ніж у хворих, яким хіміотерапія не проводилася взагалі. На користь цієї теорії говорить відповідь на звичайну хіміотерапію, що дорівнює в наших умовах 54%, що трохи нижче, ніж очікується для лікування першої лінії.14 Серед хворих, що дали рецидив захворювання, чутливого до платини, паклітаксел може компенсувати відносне зниження чутливості до платини. Інше можливе пояснення полягає в тому, що кількість платини, яку ці хворі можуть отримати під час терапії другої лінії, обмежена порівняно з кількістю, яку вони можуть отримати під час терапії першої лінії. Наприклад, лише 40% наших хворих отримали понад 90% від загальної запланованої дози карбоплатину. Для порівняння вкажемо, що приблизно 75% хворих отримали більше 90% запланованої загальної дози карбоплатину у випробуванні ICON3 при терапії першої лінії. , що і в протоколі MRC CTU, близькі до наших результатів щодо відсотка реагування, часу виживання без прогресії захворювання та токсичних ефектів. велику алопецію та неврологічні токсичні ефекти. Неврологічні токсичні ефекти відзначалися у 20% хворих, що близько до цифр, що спостерігаються при лікуванні першої лінії.6 Ця частка менша в порівнянні з очікуваною, зокрема оскільки третина хворих раніше отримувала препарат таксану. Досвід досліджень Дизону та співавт.8 є подібним, і застосування доцетакселу у 3% наших хворих могло зробити певний, хоча і незначний внесок у менший відсоток периферичного невриту. Однак дотримання призначених правил лікування було добрим, причому 72% хворих завершили принаймні шість курсів лікування. Іншою причиною, звичайно, могло бути те, що хворі зі схильністю до розвитку нейропатій не увійшли у випробування через досвід, отриманий ними під час лікування першої лінії. Звичайна хіміотерапія препаратом платини пов'язана з більш серйозними токсичними ефектами щодо кровотворення порівняно зі схемою паклітаксел/платина, що глвлрит на підтримку опублікованих раніше повідомлень, що паклітаксел може чинити захисний вплив на кістковий мозок.19 Лікування рецидивів раку яєчників містить . Тому оцінка хворої власної якості життя є важливою, щоб сказати, чи схема паклітаксел/платина матиме будь-які недоліки щодо звичайної хіміотерапії препаратом платини (або навпаки) з точки зору пов'язаних з лікуванням токсичних ефектів і безсимптомного інтервалу. Ми не виявили ясних вказівок, що якась із використаних схем є гіршою за іншу щодо функціональних аспектів, симптоматики чи глобального статусу здоров'я.
Наші результати говорять про позитивний ефект комбінації паклітаксел/платина на загальне виживання та виживання без прогресії захворювання у групі хворих з рецидивом чутливого до платини раку яєчників. Паклітаксел найчастіше комбінували з карбоплатином, а звичайна схема хіміотерапії препаратом платини, що найбільш часто застосовувалася, включала використання карбоплатину в якості єдиного агента. Тому ми вважаємо, що всі жінки, у яких рецидив розвивається пізніше, ніж через 6 місяців після завершення хіміотерапії препаратом платини, повинні розглядатися як кандидати на комбіновану хіміотерапію платиною та паклітакселом, навіть якщо вони отримували паклітаксел як складову частину схеми лікування першої лінії.
Заява про конфлікт інтересів J.A.Lederman отримав невеликий гонорар за спеціальні консультації компанії Брістол-Майєрс Сквібб.
Таблиця 1. Групи рандомізації та вихідні характеристики хворих
|
Характеристика |
Звичайна ХТ |
Паклітаксел+платина |
|
Чисельність у групі рандомізації |
||
|
Вік (роки) |
||
|
Функціональний статус щодо ВООЗ |
||
|
Запланований препарат платини |
||
|
Карбоплатин |
||
|
Цисплатін |
||
|
Остання хіміотерапія |
||
|
Пакліатаксел та карбоплатин |
||
|
Карбоплатин |
||
|
Паклітаксел та цисплатин |
||
|
Доцетаксел та карбоплатин |
||
|
Інші препарати на основі платини |
||
|
Інші препарати |
||
|
Число попередніх ліній хіміотерапії |
||
|
Невідомо |
||
|
Час після завершення останньої хіміотерапії (місяці) |
||
Таблиця 2. Лікування за протоколом під час випробування
|
Звичайна ХТ |
Паклітаксел+платина |
|
|
Лікування |
||
|
Карбоплатин (моно) |
||
|
Карбоплатин та цисплатин* |
||
|
Цисплатин та доксорубіцин |
||
|
Цисплатин (моно) |
||
|
Карбоплатин у комбінації (не з таксаном) |
||
|
Паклітаксел та карбоплатин |
||
|
Паклітаксел та цисплатин |
||
|
Паклітаксел, карбоплатин та цисплатин* |
||
|
Паклітаксел (моно) |
||
|
Лікування не проводиться чи невідомо |
||
Таблиця 3. Помірні чи тяжкі побічні ефекти під час лікування
|
Токсичні ефекти |
Звичайна ХТ |
Паклітаксел+платина |
|
Неврологічні (ступеня 2-4) |
||
|
Невідомо |
||
|
Гематологічні* |
||
|
Невідомо |
||
|
Інфекції* |
||
|
Невідомо |
||
|
Невідомо |
||
|
Мукозити (ступеня 2/3) |
||
|
Невідомо |
||
|
Нудота та блювання (ступеня 2-4) |
||
|
Невідомо |
||
|
Алопеція (ступеня 2-4) |
||
|
Невідомо |
Література
1 Parkin DM, Bray FI, Devesa SS. Cancer burden в році 2000: global picture. Eur J Cancer 2001; 37:
S4-66.
2 The ICON collaborators. ICON2: randomised trial of single-agent carboplatin проти три-drug комбінації CAP (cyclophosphamide, doxorubicin, and cisplatin) в women with ovarian cancer. Lancet 1998; 352:
1571–76.
3 Advanced Ovarian Cancer Trialists' Group. Хімічнатерапія в розширеному оваріанському Cancer: чотири systematic meta-analyses окремих пацієнтів data з 37 randomized trials. Br J Cancer 1998; 78:
1479–87.
4 Markman M, Reichman B, Hakes T, et a l. Second-line platinum терапія в пацієнтів з оваріанським очима попередньо treated with cisplatin. J Clin Oncol 1991; 9:
389–93.
5 Trimble EL, Adams JD, Vena D, et a l. Paclitaxel для platinum-рефрактори оварійський консерватор: результати від перших 1,000 пацієнтів зареєстровано до Національного академічного інституту охорони здоров'я центру 9103. J Clin Oncol 1993; 11:
2405-10 · 6
6 The International Collaborative Ovarian Neoplasm (ICON) Group. Paclitaxel plus carboplatin versus standard chemotherapy with ether single-agent carboplatin або cyclophosphamide, doxorubicin, і cisplatin в women with ovarian cancer: ICON3 randomised trial. Lancet 2002; 360:
505–15.
7 Rose PG, Fusco N, Fluellen L, et al. 2-терапія з паклітаксилом і карбоплатином для поточної погоди наступна перша-терапія з паклітаксилом і platinum в ovarian або peritoneal carcinoma. J Clin Oncol 1998; 16:
1494–97.
8 Dizon DS, Hensley ML, Poynor EA, et al. Retrospective analysis carboplatin і paclitaxel як початкова 2-терапія для реcurrent epithelial ovarian carcinoma: application toward a dynamic disease state model of ovarian cancer. J Clin Oncol 2002; 20:
1238–47.
9 Calvert AH, Newell DR, Gumbrell LA, et al. Carboplatin dosage: prospective evaluation of simple formula based on renal function. J Clin Oncol 1987; 7:
1748–56.
10 Parmar MKB, Machin D. Survival analysis: a practical approach. Chichester: John Wiley, 1995.
11 Fayers PMF, Aaronson NK, Bjordal K, Curran D, Groenvold M, на основі EORTC Quality of Life Study Group. EORTC QLQ-C30 scoring manual, 3rd edn.
Brussels: European Organization for the Research and Treatment of Cancer, 2001: 86.
12 Girling D, Parmar MKB, Stenning S, Stephens R, Stewart L. Clinical trials in cancer.
Oxford: Oxford University Press, 2003.
13 Cantu MG, Buda A, Parma G, et al. Зблизька контрольована тріаль одного agentа paclitaxel versus cyclophosphamide, doxorubicin, і cisplatin в пацієнтів з сучасним ovarian cancer, який відповідає на першу-лінію platinum-базованих регіонів. J Clin Oncol 2002; 20:
1232–37.
14 McGuire WP, Hoskins W, Brady MF, та ін. Cyclophosphamide і cisplatin compared with paclitaxel і cisplatin в пацієнтів з період III і IV оваріанний очисник. N Engl J Med 1996; 334:
1–6.
15 Piccart MJ, Bertelsen K, James K, et al. Зблизька міжгрупа триалом cisplatinpaclitaxel versus cisplatin-cyclophosphamide в women with advanced epithelial ovarian cancer: 3-year результат. J Natl Cancer Inst 2000; 92:
699–708.
16 Muggia FM, Braly PS, Brady MF, та ін. p ase III randomized study cisplatin versus paclitaxel versus cisplatin і paclitaxel в пацієнтів з suboptimal період III або IV ovarian cancer: gynecologic oncolology group study. J Clin Oncol 2000; 18:
106–15.
17 Sandercock J, Parmar MKB, Torri V, et al. Перший-лінійний додаток для розширеного оварійського консерватора: paclitaxel, platinum and evidence. Br J Cancer 2002; 87:
815–24.
18 Gonzalez Martin AA, Calro E, Bover I, et al. Зблизька фази II вивчення карбоplatin versus paclitaxel-carboplatin в platinum-sensitive recurrent advanced ovarian carcinoma with assessment of quality life: GEICO study (Spanish Group for Investigation on Ovarian Carcinoma). Proc ASCO 2003; 22:
(Abstr 1812).
19 van Warmerdam LJ, Huizing MT, Giaccone G, et al. Клінічна фармакологія карбоplatin застосовується в комбінації з paclitaxel. Semin Oncol 1997; 24
(Suppl 2 ):
97–104.
Мал. 1. Профіль випробування
Мал. 2. Загальне виживання 
Мал. 3. Виживання без прогресії 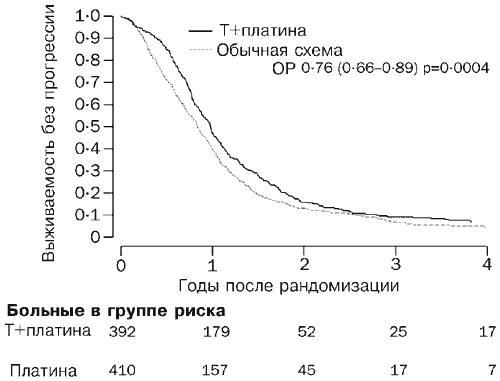
Мал. 4. Ефект XT комбінацією Т+платина на загальне виживання у підгрупах 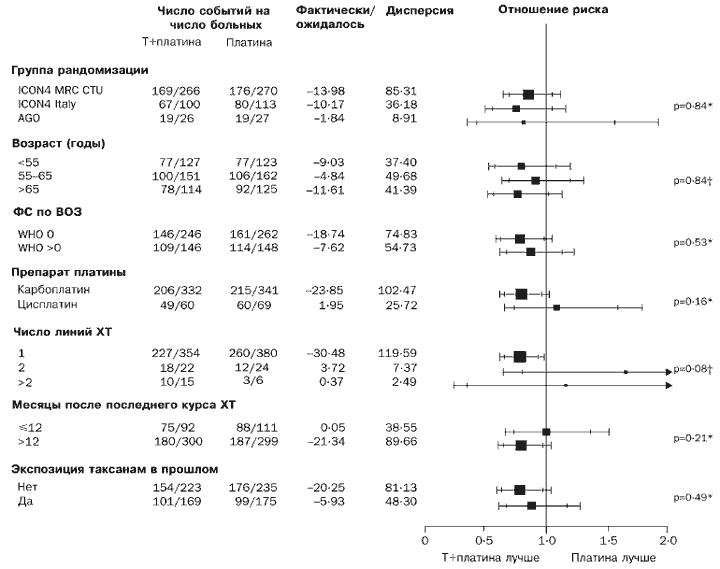
*Взаємодія
Тренд
Скорочення: Т – паклітаксел; XT – хіміотерапія; ФС – функціональний статус.
Належить до основних методів лікування злоякісних пухлин. Препарати, що використовуються в процесі лікування, спрямовані на знищення ракових клітин або придушення процесу їх розмноження. Застосування хіміотерапії дозволяє збільшити тривалість життя пацієнта, зменшити симптоми.
Скільки коштує лікування?
На вартість хіміотерапії впливають такі фактори:
- Умови проведення. Лікування може проводитися як у стаціонарі, так і амбулаторно. При проживанні у стаціонарі вартість буде вищою. Однак навіть за бажання скоротити вартість курсу хіміотерапії, необхідно враховувати, що не завжди є можливість провести ефективне лікування амбулаторно.
- Ціна препаратів. У лікуванні використовуються кілька різних категорій препаратів. Можуть використовуватися не тільки оригінальні засоби, а й дженерики – медикаменти з аналогічним складом, які випускаються іншою компанією. Такі аналоги коштують дешевше.
- Протокол лікування. Схеми лікування, призначені для терапії одного і того ж типу пухлини, можуть бути різними і включати різні спискимедикаментів. Отже, коли призначено хіміотерапію, вартість може змінюватись в залежності від набору препаратів.
- Допоміжне лікування та додаткові процедури. Спеціальна підготовкаможе знадобитися перед проведенням хіміотерапії: вона необхідна зниження ризику розвитку побічних дій, зменшення їх інтенсивності. Обов'язково повинна проводитися підтримуюча терапія під час лікування, а також прийом препаратів після завершення курсу відновлення порушених функцій.
- Використання інших методів. Крім хіміотерапії пацієнт може потребувати й іншої медичної допомоги: проведення хірургічного втручання, променевої терапії, застосування таргетних, гормональних препаратів. Залежно від переліку цих методів змінюватиметься вартість хіміотерапії при раку.
Препарати, які можуть використовуватись
При проведенні хіміотерапії можуть використовуватись препарати наступних груп:
- алкілуючі;
- антрацикліни;
- похідні платини;
- ракові антиліотики;
- вінкалкалоїди;
- цитостатики;
- таксани.
Необхідно враховувати, що препарати, що використовуються під час хіміотерапії, працюють щодо активних клітин. Це означає, що за наявності великої кількостіклітинних структур, що у сплячій фазі, пухлина може бути досить стійка до їх впливу.
Алкілуючі агенти
Під впливом препаратів відбувається загибель клітин пухлини через пригнічення синтезу певних білків.
Небезпека застосування цих засобів полягає у ймовірності виникнення лейкемії.
До алкілуючих агентів відносяться:
- Циклофосфамід;
- Ембіхін;
- Іфосфамід;
- Хлорамбуціл.
Нижче наведено приклади препаратів цієї категорії, які використовуються при хіміотерапії, ціна варіюється:
- Вінбластін;
- Вінкрістін;
- Винорельбін.
Антибіотики протиракові
Препарати, призначені для уповільнення генного поділу ракових клітин. Побічні ефекти під час використання медикаментів цієї категорії частіше виникають щодо легеневих структур, т.к. виявляється токсичний впливна легені.
Найчастіше використовуються: Адріаміцин, Блеоміцин. Найбільш поширеною є комбінація з цитотоксином.
- Мітоміцин;
- Епірубіцин.
Антрацикліни
Це речовини, що ушкоджують ДНК онкоклітин. До антрациклінів належать Даунорубіцин, Доксорубіцін. Це препарати, що виготовляються із натуральної сировини. Чинним компонентом є складова ґрунтових грибків. Антрацикліни – препарати, що показують свою ефективність у боротьбі з онкоклітинами, проте вони мають і безліч побічних ефектів, пов'язаних із роботою серцево-судинної системи.
- Адрібластін;
- Заведос;
- Доксорубіцин.
Антиметаболіти
Речовини, що вбудовуються в генетичний клітинний код. Зміни, що відбуваються, призводять до того, що в процесі розподілу відбувається загибель клітини.
Препарати цієї категорії: Метотрексат, Гемзар, Гемцітабін. Одним із широко застосовуваних засобів є 5-фторурацил. Він давно використовується в хіміотерапії ракових пухлин та показав свою ефективність, проте також характеризується побічними діями. Він може вплинути на кістковий мозок, спровокувати інтоксикації шлунково-кишкового тракту, вироблення нейротоксинів, які призводять до виникнення судом, коми.
Коли потрібна хіміотерапія, ціна на препарати може стати ключовим фактором, що визначає вибір. Антиметаболіти в аптеці представлені в різних цінових категоріях:
- Метотрексат;
- фторурацил;
- Кселода;
- Меркаптурін.
Похідні платини
Належать до важких токсичних металів. Найбільш поширені:
- Цисплатин (надає сильний токсичний вплив на нирки);
- Карбоплатин (препарат 2-го покоління, токсична діяменше);
- Оксаліплатин (перпарат 3-го покоління, на нирки негативного впливу не чинить, проте може призвести до невропатій).
Цитостатики
Цитостатики діють за принципом алкілуючих агентів або антиметаболітів. Найбільш поширеними є Капецитабін, Таксол.
Таксани
Таксани використовуються при раку легені, і . Як побічний ефект називають зниження якості клітин крові.
Препарати, які застосовуються для відновлення після хімії
З метою відновлення призначаються традиційні медикаменти та фітопрепарати. Відновлюючу терапію можна починати ще в ході ХТ або відразу після неї.
Критично знижується рівень лейкоцитів, імунітет знижується у рази. Для відновлення імунної функціїзастосовують імунофол, поліоксидоній.
За відсутності необхідного ефекту їх замінюють на сильнодіючі засоби: Батилол, Лейкоген, Цефарансин, Метилурацил.
На печінку виявляються дуже серйозні навантаження, оскільки їй доводиться виводити дуже багато токсинів. Для відновлення застосовують:
- Гепастерил;
- Гепамін;
- Сирепар;
- Карсіл.
Дисфункція нирок проявляється постійним блюванням, діареєю. Відновлення органу проводиться за допомогою Уропроту, Урометоксану.
Для відновлення серцево-судинної системи застосовують: Аспаркам, Предуктал, Мілдрокарт.
Безліч побічних ефектів при хіміотерапії розвивається з боку кишечника та травної системи. З нудотою, блюванням, діареєю стикається кожен пацієнт. Прийом препаратів супроводжується запальним процесом у кишечнику, і на сьогоднішній день немає ліків, які могли б повністю запобігти запаленню.
Для відновлення використовують такі препарати як:
- Проксіум;
- Нексіум;
- Квамател.
Профілактика депресії. З огляду на комбінування препаратів при хіміотерапії розвивається дуоденальна депресія. Виникає вона через синтезування у 12-палій кишці низки гормонів. Запалення призводить до порушення балансу нейропептидів.
З лікарських препаратів використовують:
- Афабазол;
- Фезам.
Від чого залежить вартість?
Хіміотерапія проводиться курсами. Після закінчення одного курсу потрібна перерва для відновлення. Тривалість та кількість циклів, загальна тривалість лікування залежатиме від типу, стадії раку, застосовуваних препаратів. Усе це вплине ціну лікування загалом. Вартість хіміотерапії залежить від форми випуску препаратів, обсягу, необхідного для лікування.
Крім ціни на препарати, яка не завжди становить основну частку витрат, ціна хіміотерапії при раку, озвучена медичними центрами, передбачає оплату послуг без урахування медичних препаратів.
Тут також слід зазначити, що може бути суттєва різниця між цінами в державних центрах та приватних клініках.
Вартість хіміотерапії у Москві залежить від обраного закладу, і класифікується на такі види:
- фракційне запровадження хіміотерапевтичного препарату (хіміотерапія ціна за 1 курс);
- інфузійне введення хіміотерапевтичного препарату;
- дозовані інфузії;
- цілодобові інфузії хіміопрепаратами.
Тривалість лікування
Хіміотерапія здійснюється зазвичай внутрішньовенно. Середня тривалість лікування – 2-3 тижні.
Онкологія легень – лікування внутрішньовенне, тривалість – 2,3,4 тижні.
Онкологія матки. Застосовуються поєднання Таксолу, Доксорубіцину, Карбоплатину, Цисплатину.
Як правило, використовуються 2 та більше препаратів.
Онкологія яєчників. Доцільно використовувати препарати платини у комбінації з Паклітакселом, Доцетакселом. Має на увазі внутрішньовенне введення.
Онкологія шлунка. Препарати можуть застосовуватись перорально або внутрішньовенно. Тривалість циклу лікування може становити 14,21,28 днів.
Якщо проводиться за кордоном хіміотерапія, вартість буде вищою. Наприклад, вартість хіміотерапії в Німеччині приблизно така:
- пухлина сполучної тканинипри 7-денному перебування в клініці при високоскладній терапії – від 6 до 12 тисяч євро;
- при локальній хіміотерапії – від 4 до 7,5 тисячі євро;
- середньо-складна хіміотерапія – 4,5-7,5 тисячі євро.
При цьому слід додати витрати на дорогу.
Вартість хіміотерапії залежатиме, у тому числі і від того, на якій стадії перебуває захворювання. Якщо пухлина за розміром невелика і не встигла сформувати метастази, лікування пройде легше та швидше. Як і в будь-якому іншому захворюванні при раку дуже важливо якнайшвидше виявити новоутворення і невідкладно вжити заходів. Не слід відкладати лікування, при виявленні новоутворення необхідно одразу записатися прийом до онколога.
Catad_tema Онкологія - статті
Параплатин: У чому переваги похідних платини другого покоління?
Онкологія
Складання: С.А.Тюляндін
Онкологічний науковий центр ім. Н.Н.Блохіна РАМН
Цей документ розроблено, щоб відповісти на очікувані запитання лікарів щодо онкологічних препаратів Брістол-Майєрс Сквібб.
Думки, висловлені в цій статті, є приватними поглядами автора і не призначені для представлення офіційної позиції Брісто-Майєрс Сквібб.
Частина інформації, що міститься в брошурі, може відрізнятися від рекомендованих Брістол-Майєрс Сквібб дозувань, показань та способів введення. У зв'язку з цим, за повною інформацією звертайтесь до інструкції щодо застосування препарату.
Детальну інформацію про протипухлинні препарати Брістол-Майєрс Сквібб ви можете отримати у Російському Представництві Компанії.
Значення похідних платини
Найбільш ефективні препаратипри лікуванні:
- недрібноклітинного раку легені;
- дрібноклітинного раку легені;
- плоскоклітинного раку різних локалізацій(рак голови та шиї, стравоходу, шийки матки);
- раку яєчника;
- пухлин яєчника;
- остеогенної саркоми.
Навіщо потрібні препарати аналоги?
- підвищення протипухлинної активності
- розширення спектру дії
- зниження токсичності
- зменшення вартості лікування
Розглянемо з цих позицій два похідних платини, що є у розпорядженні онкологів: цисплатин, препарат першого покоління, і параплатин - похідне платини другого покоління.
Цисплатин та параплатин однаково ефективні при лікуванні:
- недрібноклітинного раку легені
- дрібноклітинного раку легені
- раку яєчника
Цисплатин і параплатин однаково ефективні при раку яєчника
Дослідження SWOG - Alberts D. 1992Дослідження NCIC - Swenerton К. 1992
Комбінація цисплатин-циклофосфан та параплатин-циклофосфан однаково ефективні при лікуванні хворих на рак яєчника III-IV стадії за даними дослідження Південно-Східної Онкологічної Групи (SWOG) та Національного інституту раку Канади (NCIC). Об'єктивний ефект становив 50-57% і 59-61% відповідно за рівної тривалості життя.
Цисплатин параплатин однаково ефективні при дрібноклітинному ракулегені
Bunn Р.1992Однакова протипухлинна активність комбінацій цисплатин - етопозид і параплатин - етопозид зареєстрована при дрібноклітинному раку легені. При цьому комбінація з включенням параплатину має меншу токсичність.
Цисплатин і параплатин однаково ефективні при недрібноклітинному раку легені
Klastersky J. 1990Аналогічні результати, щоправда, більш скромні з точки зору протипухлинної активності, були отримані при лікуванні хворих на недрібноклітинний рак легені.
Порівняння протипухлинної активності похідних платини
Цисплатин та параплатин однаково ефективні при використанні еквівалентних доз.
Цисплатин і параплатин можуть бути однаково ефективні за дотримання еквівалентності доз двох препаратів: доза цисплатину 100 мг/м 2 відповідає параплатину в дозі 400 мг/м 2 .
Заміна цисплатину на параплатин знижує ефективність лікування хворих:
- герміногенними пухлинами яєчка або яєчників
- плоскоклітинним раком голови та шиї
Порівняння спектра протипухлинної дії
Цисплатин і параплатин мають однаковий спектр протипухлинної дії.
Параплатин - один із найбільш популярних препаратів при проведенні високодозної хіміотерапії з подальшим відновленням кістковомозкового кровотворення.
Цисплатин і параплатин мають однаковий спектр протипухлинної дії. Можна відзначити, що, на відміну від цисплатину, параплатин є одним з найбільш популярних препаратів при проведенні високодозної хіміотерапії з подальшим відновленням кістковомозкового кровотворення.
Показання до заміни цисплатину на параплатин
- знижена функція нирок або високий ризикнефротоксичності
- ознаки нейротоксичності чи високий ризик її розвитку
- важка нудота та блювання при використанні цисплатину
- загальне поганий станпацієнта
- необхідність проведення лікування амбулаторно
Порівняння токсичності похідних платини
Wiltshow E. 1985У цій таблиці наведено порівняння частоти різних ускладненьпри застосуванні цисплатину та параплатину у хворих на поширений рак яєчників. У цьому дослідженні функція нирок оцінювалася за рівнем ниркової фільтрації радіоактивно міченої EDTA. Зниження ниркової фільтрації значно частіше спостерігали при призначенні цисплатину. Лікування параплатином рідше супроводжувалося розвитком блювоти, периферичної нейропатії, зниженням слуху, анемією, у той час як лейкопенія та тромбоцитопенія були більш частими ускладненнями порівняно з цисплатином.
Вартість лікування
Більш висока токсичність цисплатину відбивається на вартості лікування, оскільки вимагає перебування у стаціонарі, проведення гідратації та постгідратації, призначення антиеметиків, як правило, протягом кількох днів, здійснення контролю за станом функції нирок після введення препарату.
Вартість лікування
Calvert A.H. 1991
Призначення параплатину замість цисплатину зменшує вартість курсу лікування, як у Великій Британії, так і в США, незважаючи на те, що ціна самого параплатину значно вища, ніж цисплатина. Різниця у вартості лікування у цих двох країнах пояснюється більш високою вартістюперебування у стаціонарі у США.
Параплатин: розрахунок дози
- площа тіла
- функція нирок, оскільки препарат виділяється нирками
Успішне застосування тих чи інших ліків багато в чому залежить від правильності вибору дози. Згідно з офіційними рекомендаціями фірми-виробника, розрахунок дози параплатину проводиться з урахуванням площі поверхні тіла хворого та функціонального стану нирок, що характеризується величиною кліренсу креатиніну. Доза параплатину зменшується при зниженні кліренсу креатиніну, а при величині останнього менше 15 мл/годину введення препарату протипоказане.
Кліренс креатиніну (проба Реберга)
концентрація креатиніну в сечі/
концентрація креатиніну у сироватці
х
хвилинний діурез
=
кліренс креатиніну
(Показник клубочкової фільтрації)
Доречно нагадати, що кліренс креатиніну визначається за допомогою проби Реберга. Для цього хворий збирає добову сечу. Визначається хвилинний діурез шляхом поділу добового об'єму сечі на час збирання сечі за хвилини. Після цього визначається концентрація креатиніну у зібраній добовій сечі та сироватці крові. Результат розподілу цих величин множать на хвилинний діурез, що, зрештою, дає цифру кліренсу креатиніну, важливого показника рівня клубочкової фільтрації.
Кліренса креатиніну (формула Коккрофта)
До х (140 - вік) х вага в кг/
креатинін сироватки
К = 1,05 для жінок
К = 1,23 для чоловіків
Cockroft & Gault 1976
Кліренс креатиніну можна визначити також за допомогою формули Коккрофта, знаючи концентрацію сироваткового креатиніну, вік, вагу та стать пацієнта. Це зручніший, швидкий і, як показали спеціальні дослідження, досить точний метод визначення кліренсу.
Параплатин: розрахунок дози
зниження функції нирок
подовження життя препарату в крові
збільшення часу дії препарату на кістковий мозок
лейкотромбоцитопенія
Навіщо важливо правильно оцінити функціональний стан нирок під час введення параплатина? Зниження рівня ниркової фільтрації збільшує тривалість циркуляції параплатину в крові, тим самим збільшуючи час впливу препарату на кістковий мозок. Наслідком цього є посилення гематологічної токсичності, що проявляється розвитком лейкотромбоцитопенії.
AUC (мг хв/мл) = мг/мл х t хв
Для реалізації протипухлинного ефекту необхідно створити певну концентрацію препарату у крові на певний час. На цьому малюнку показано, що відбувається з параплатином при внутрішньовенному його введенні. Крива концентрації спочатку підвищується, а потім у міру виділення препарату нирками знижується. Площа під кривою або AUC (англійська абревіатура Area Under the Curve) є похідною концентрації препарату в крові протягом певного відрізку часу. При рівній функціональній здатності нирок AUC буде більшим у пацієнта, який отримав велику дозу. При введенні однакових доз препарату велика AUC буде одержана у хворих з порушеною функцією виділення нирок.
Особливості фармакокінетики параплатину: площа під кривою (AUC)

Визначено, що AUC = 5-7,5 мг
х хв/мл оптимальна з точки зору протипухлинної активності та токсичності
Величина AUC безпосередньо залежить від разової дози параплатину та функції стану нирок. Крім того, величина AUC корелює з протипухлинною активністю та токсичністю препарату. Чим більша величина AUC, тим вираженіший протипухлинний ефект препарату, зокрема, у хворих на герміногенні пухлини яєчка. Разом з тим підвищення AUC лімітується розвитком гематологічної токсичності. Було визначено, що оптимальним з точки зору ефективності та токсичності є величина AUC в діапазоні 5-7.5 мг x мл/хв. На підставі цих даних було розроблено інший спосіб розрахунку дози параплатину, що враховує бажану величину AUC та функціональний стан нирок хворого.
Параплатин: розрахунок дози
Формула Калверта
Доза параплатину (мг) = AUC x (GRF + 25)
GRF - швидкість клубочкової фільтрації
Доза параплатину (мг) = AUC х (Кліренс креатиніну + 25)
Доктор Калверт з Великобританії запропонував формулу для розрахунку разової дози параплатину, в якій величина бажаної AUC множиться на суму швидкості клубочкової фільтрації (GRF) плюс 25. Спочатку швидкість клубочкової фільтрації визначалася радіоізотопним методом. Зараз визнано можливим у формулі Калверта замість швидкості клубочкової фільтрації використовувати показник кліренсу креатиніну, визначеного за допомогою проби Реберга, або розрахованого за формулою Коккрофта. Важливо пам'ятати, що за формулою Калверта доза параплатину розраховується мг, а чи не мг/м 2 .
Параплатин: розрахунок дози за формулою Калверта
Доза параплатину, розрахована з урахуванням AUC, більшою мірою корелює з протипухлинним та токсичним ефектами препарату порівняно з емпіричною (мг/м 2 ).
Проведені клінічні дослідженняпоказали, що доза параплатину, розрахована з урахуванням AUC, більшою мірою корелює з протипухлинним та токсичним ефектами препарату порівняно з емпіричною (мг/м 2 ). Таким чином, розраховуючи дозу параплатину за формулою Калверта, Ви досягаєте індивідуального підбору дози, оптимальної для конкретного хворого з точки зору протипухлинної ефективності та токсичності.
Параплатин: у чому переваги похідних платини другого покоління?
- рівна протипухлинна активність
- однаковий спектр протипухлинної активності
- менша токсичність
- менша вартість лікування
- можливість визначення дози на основі ключових фармакокінетичних параметрів
Зверніть увагу, що протиракові антибіотики не мають нічого спільного з традиційними антибіотичними препаратами. Принцип дії антибіотиків ґрунтується на уповільненні поділу генів ракових клітин. Найпопулярніший препарат цієї групи – Адріаміцин. Цей препарат використовують у схемі з Цитотоксином.
Антиметаболіти
Принцип дії цих препаратів ґрунтується на вбудовуванні в генетичний апарат ракової клітини. Коли ракова клітка починає ділитися, вона гине від дії препарату. До цієї категорії відноситься: 5-фторураці та Гемцитабін (Гемзар).
Антрацикліни
Препарати цієї групи мають у своєму складі антрациклінове кільце, яке взаємодіє з ДНК ракових клітин. Хіміопрепарати інгібують топоізомеразу-II та утворюють вільні радикали, які й ушкоджують ДНК структуру ракових клітин. Представники цієї групи препаратів: Рубоміцин, Адрібластін.
Вінкалкалоїди
Препарати для хіміотерапії рослинного походження (лікарська рослина Vinca rosea). Механізм дії ґрунтується на зв'язуванні білка тубуліна, який формує цитоскелет. Цитослекет – це невід'ємна частина клітини, яка спостерігається при мітозі та у фазі спокою. Знищення цитоскелету призводить до порушення міграції хромосом у процесі поділу клітини, що призводить до її загибелі. Особливість даного препарату в тому, що до його дії чутливіші ракові клітини, а не здорові. Завдяки цьому ліки мають мінімальні побічні ефекти. До цієї групи препаратів відносяться: Вінбластін, Віндезін, Вінкрістін.
Препарати платини
Платина - це важкий метал, який токсичний для людського організму. Механізм дії платини схожий на алкілуючі агенти. Після потрапляння всередину препарат взаємодіє з ДНК клітинами, руйнуючи їхню структуру та функції.
Епідофілотоксини
Є синтетичними аналогами екстракту мандрагори. Препарат впливає на ядерний фермент топоізомеразу-II та ДНК. Препарати з цієї групи: Теніпозід, Етопізид.
Інші цитостатики
Мають комбінований принцип дії, схожий з усіма вищеописаними препаратами. Так, частина цитостатиків за механізмом дії схожі з алкилирующими агентами (Прокарбізин, Дакарбазин), частина пригнічує топоізомеразу, а частина працює як антиметаболіти (Гідроксимочевина). Хороші цитотастатичні властивості мають кортикостероїди, які також використовують для лікування онкологічних захворювань.
Таксани
Ці препарати впливають на мікротрубочки. До категорії таксанів відносять: Паклітаксел, Доцетаксе та таксани, що мають функціональні властивості. Препарати для хіміотерапії стабілізують мікротрубочки та не допускають їх деполімеризації. Це порушує нормальний процесреструктурування мікротрубочок у клітині, що має важливе значення для процесу поділу ракових клітин.
Кожна з вищеописаних груп хіміопрепаратів має свої особливості, принцип дії та побічні ефекти. Крім того, для використання кожного з препаратів онкологи розробляють спеціалізовані протоколи лікування. Протоколи ефективні навіть за мінімального негативного впливу організм. Усі лікувальні протоколи постійно вдосконалюються у найкращих світових клініках лікування онкології. Це підвищує виживання пацієнтів з онкологією та покращує якість їхнього життя.
Препарати для відновлення після хіміотерапії
Препарати для відновлення після курсу хіміотерапії – це лікарські засоби, які дозволяють відновити здоров'я та зменшити побічну симптоматику хіміолікування. Для реабілітаційного процесу можуть використовуватись як традиційні лікарські засоби, і фітопрепарати. Відновлювальний курс складається індивідуально кожному за хворого. Лікування рекомендується розпочинати відразу після закінчення курсу хіміопроцедур або одночасно з прийомом хіміопрепаратів для зменшення побічної симптоматики та захисту органів від дії протиракових ліків.
Патологічне стан чи хімічна хвороба розвивається через прийом однієї чи кількох лікарських засобів. Захворювання називають побічними ефектами лікарських засобів, оскільки є частиною механізму їх дії. Відновлення після курсу хіміотерапії або профілактика хімічної хвороби залежить від типу хіміолікування та уражених раком органів.
Давайте розглянемо найефективніші препарати для відновлення після хіміотерапії та процес відновлення уражених органів:
- Відновлення нирок
Після курсу хіміотерапії при ураженні нирок пацієнти страждають від постійного блювання та діареї. Це дуже небезпечний стан, оскільки разом з блювотою та проносом з організму у великих кількостях виводиться соляна кислота та натрію хлорид, без яких неможлива нормальна робота надниркових залоз та нирок. Надниркові залози перестають виробляти гормон адреналін, глюкортикоїди та мінералокортикоїди. Подібна симптоматика відповідає гострій течіїХімічна хвороба. Для відновлення нирок використовують такі препарати як: Уропрот, Урометоксан.
- Відновлення крові
Такі показники, як загальний аналіз крові, біохімія крові, ШОЕ та лейкоцитарна формула – це показники, які відповідають за здоровий станкрові та всіх органів. Саме за цими критеріями оцінюють ефективність хіміотерапії та загальний станпацієнта. Якщо пацієнт уникнув першої стадії хімічної хвороби, незабаром настає друга, тривалість якої до 7 днів. Саме в цей період у пацієнтів з'являється набряклість, інфільтрація, некроз та руйнування епітелію. шлунково-кишковий трактта паростків кісткового мозку.
Подібний стан супроводжується загибеллю еритроцитарних паростків кісткового мозку, що призводить до масивних порушень обмінних процесів. Як результат – анемія, тромбоцитопенія, лейкопенія. У пацієнтів з'являються кровотечі, синці, можливі крововиливи у внутрішні органи. Процес відновлення крові полягає у переливанні еритроцитарних та тромбоцитарних мас і як радикальна терапія – пересадка кісткового мозку. Але такий відновлювальний процес має недоліки. Близько 45% пацієнтів заражаються вірусом гепатиту С, В та іншими вірусами, які супроводжуються протягом усього життя. Існує ряд препаратів, які дозволяють відновити кров після хіміотерапії: Філстім, Нейпоген, Зарсіум, Грастім.
- Відновлення мікрофлори та імунної системи
На тлі зниженої імунної системи після курсу хіміотерапії, у пацієнтів починає розвиватися інфекція, а умовно-патогенна флора набуває хвороботворних властивостей. Через загальну інтоксикацію організму, пацієнти страждають від грибкових інфекцій. Так, у 100% випадків у пацієнтів розвивається кандидоз. Можливий розвиток стафілокока, який поширюється по всіх найдрібнішим артеріям. Через це у хворого з'являються осередки запалення, множинні осередкинекрозу з перфорацією шкіри, сепсис, кровотечі та тромбози.
У 70% випадків відсутність відновлювальну терапіюприводить до смерті. Для попередження розвитку вищеописаного стану, відновлення імунітету та мікрофлори пацієнтам призначають такі препарати, як: Лакта, Лаціум, Лактовіт-Форте, вітаміни групи В, Нейрорубін, Аскорбінова кислота.
- Відновлення печінки
Після курсу хіміотерапії від ефективності роботи печінки залежить функціонування органів та систем та резервні можливості тканин та органів організму. Печінкова тканина є головним буфером з переробки, виведення та отримання речовин з організму. Будь-який хіміопрепарат або просто лікарський препарат, введений в організм, виводиться за допомогою печінки та впливає на печінкову функцію.
Прямий сильний вплив, надають на печінку активні речовини та їх метаболіти, а непряме – супутні ефекти, які вони викликають в організмі. Так, зміна в параметрах крові призводить до утруднення функції гепатоцитів, пошкоджує нирки і дають сильне навантаження токсичних речовин на печінку. Через інфекцію клітини печінки можуть вийти з ладу. Для відновлення печінки використовують такі препарати: Гепадиф, Глуроргін, Карсил, Есенціалі Форте-Н.
- Відновлення серцево-судинної системи
Багато пацієнтів перед операцією або до прийому хіміопрепаратів страждають від вегето-судинної дистонії та гіпертонії. Але після видалення джерела токсинів, тобто пухлин, тиск стабілізується. Приміром, Доксорубицин утворює вільні радикали, які посилюють пошкодження мембран. Через це препарат вважається одним із самих кардіотоксичних. Для відновлення серцево-судинної системи після хіміотерапії використовуються такі препарати, як: Аспоркам, Предуктал, Мілдрокарт.
- Відновлення кишечника та травної системи
Негативні наслідки хіміотерапії найбільше проявляються з боку кишківника. Пацієнти страждають від блювання, відчуття нудоти та діареї. Але на сьогоднішній день немає засобів, які б повністю захищали слизову оболонку кишківника від запального процесу. Через це хворі скаржаться на оперізуючі болі, порушення травлення, відсутність апетиту, діарею, рідкий стілець, пронос, коліт, запори. У деяких пацієнтів через порушення травної системи та кишечника з'являється кандидоз, диспепсія та дисбактеріоз. Оскільки запалений кишечник неспроможний повноцінно перетравлювати їжу, то відновлення після курсу хіміотерапії, використовують такі препарати, як: Лакта, Проксиум, Нексиум, Квамател.
- Профілактика депресії
Дуже часто після хіміотерапії у пацієнтів через взаємодію медикаментів з'являється депресія, яка поводиться як дуоденіт. Дуоденальна депресія виникає через вироблення у дванадцятипалій кишці не тільки травних гормонів, а й гормонів загальної дії, які впливають на людську поведінку. Через запальний процес порушується баланс нейропептидів. Для боротьби з цією недугою використовують такі препарати, як: Афабазол, Фезам та інші.
Відновне лікування полягає у застосуванні препаратів з груп стероїдних та нестероїдних протизапальних засобів, антигіпоксантів, антиоксидантів, знеболюючих та вітамінів. Але медикаментозна терапія не завжди дає бажані результати. Багато пацієнтів віддають перевагу відновлювати організм за допомогою натуральних та безпечних методів. Для цих цілей використовують супровідну фітотерапію та проводять фітооздоровлення.
Супровідна фітотерапія являє собою застосування рослинних витяжок, які мають високу протизапальну активність. Процес фітолікування полягає у проведенні фітодетоксикації та фітооздоровлення на всіх етапах лікування онкохворого. Терапія полягає у профілактиці віддалених наслідків опромінення та хіміотерапії, а також у попередженні рецидивів захворювання.
Препарати платини для хіміотерапії
Препарати платини для хіміотерапії – це сучасний та ефективний метод лікування ракових захворювань. Наприклад, найпопулярніший препарат платини – Цисплатин був випробуваний ще 1978 року у США. Спочатку препарат розроблявся для лікування раку яєчка, але на сьогоднішній день застосовується для лікування ракових уражень легень, при раку яєчників та при лімфомах. Але навіть препарати платини викликають побічні ефекти, що виявляються як яскраво виражена токсична дія та формування лікарської резистентності на клітинному рівні.
Серед пацієнтів з раковими захворюваннями існує думка, що якщо почали застосовувати препарати платини, то справи дуже погані. Але насправді це негаразд. Хіміотерапія платиною використовується у тому випадку, коли інші препарати не дали належного результату. Це стосується ракових поразок. сечового міхура, легень, яєчників та інших онкологічних захворювань Найсуттєвішим протипоказанням до застосування препаратів платини є виражена ниркова недостатність. Через це терапія стає менш прогресивною.
На сьогоднішній день замість препарату Цисплатини планують використовувати Фенантриплатин, який ефективніше проникає в уражені онкологією клітини та інгібує транскрипцію. Механізм дії препаратів платини полягає в цитостатичній дії, яка повністю заснована на появі в ДНК поздовжніх та внутрішньоланцюжкових зв'язків, що формують перешкоди до реплікації. Це виникає через склад препаратів, основа яких – платиновий атом із двома іонами хлору та амонієвими лігандами.
Серед усіх важких металів, лише сполуки платини – Карбоплатин і Цисплатин застосовують як протипухлинні препарати. Дані засоби не відносяться до алкілуючих препаратів, тому що вони формують перехресні зшивки цінніших ДНК. Розглянемо докладніше лікарські препарати на основі платини:
Цисплатін
Протипухлинний препарат, похідний платини. Засіб має здатність до руйнування ДНК ракових клітин, викликаючи регресію пухлин та метастазів. Особливість даного препарату в тому, що він неефективний при пероральному прийомі. А ось при внутрішньовенному застосуванні препарат швидко і у великих дозах надходить в органи та системи. Цисплатин не проникає через гематоенцефалічний бар'єр, а зв'язуваність з білками крові становить 90%. Виводиться нирками, повільно, у перші години виходить близько 40% препарату, решта протягом п'яти днів з моменту введення.
- Показання до застосування. Цисплатин використовується як у комплексній терапії, у поєднанні з протипухлинними антибіотиками та іншими препаратами, так і як монотерапія. Лікарський засіб використовують для лікування злоякісних уражень яєчників, сечового міхура, яєчок, при раку шийки матки, остеогенної саркоми, плоскоклітинному раку голови. Цисплатин ефективний у складі комплексної терапії при лікуванні раку лімфатичної системи, лімфосаркоми.
- Спосіб застосування. Розчин Цисплатин вводять внутрішньовенно. Якщо використовується монохіміотерапія, то пацієнту вводять 20 мг препарату на 1 м² поверхні тіла протягом п'яти днів або по 30 мг протягом трьох днів. Більше високе дозуванняу 100-150 мг має на увазі введення препарату раз на три тижні. Інтервал між курсами має становити щонайменше три тижні. Кількість курсів визначається індивідуально кожному за пацієнта. При введенні 10 мг Цисплатин розчиняють у 10 мл стерильної води для ін'єкцій, отриманий розчин розводять у 1000 мл ізотонічного розчину натрію хлориду або у 5% розчині глюкози. Вводять препарат струминно, як тривалих інфузій. Для того, щоб мінімізувати негативний впливна нирки, перед введенням Цисплатину рекомендується гідратувати організм хворого.
- Цисплатин може викликати порушення у роботі нирок, провокувати напади нудоти, блювання, запаморочення, втрату апетиту, зниження слуху чи шум у вухах. Можливі алергічні реакції та різке зниження лейкоцитів та тромбоцитів у крові. У деяких пацієнтів Цисплатин викликає нейропатію, яка вражає нерви нижніх кінцівок. У процесі введення препарату пацієнт може відчувати біль під час вени.
- Протипоказання. Цисплатин не рекомендується використовувати при порушеннях функцій печінки та нирок, проблемах з кістковомозковим кровотворенням, при виразці шлунка, вагітності та індивідуальній непереносимості препарату. Цисплатин протипоказано поєднувати з лікарськими засобами, які ушкоджують нирки та органи слуху, а також зі стрептоміцином та антибіотиками-аміноглікозидами.
- Препарат випускають у ампулах для ін'єкцій по 0,001 до 10 штук в упаковці. Цисплатин являє собою жовту масу неоднорідної забарвлення, яка легко розпадається в порошок. Зберігати Цисплатин необхідно в захищеному від сонячного світла місці при температурному режимі не вище +10 °С. Відпускається лише за рецептом.
Карбоплатин
Протипухлинний засіб, групи платинових похідних. Механізм дії заснований на придушенні біосинтезу нуклеїнових кислотта загибелі ракових клітин. На відміну від препарату Цисплатин, Карбоплатин має мінімальний шкідливий вплив на нирки, ототоксичність та нейротоксичність.
- Показання до застосування. Карбоплатин призначають пацієнтам з раковими ураженнями яєчників, яєчок, при семиномі, меланомі, раку шийки матки, раку сечового міхура, остеогенній саркомі, пухлинах шиї та голови.
- Застосовують препарат лише внутрішньовенно. Дорослим пацієнтам вводять по 400 мг на 1 м 2 поверхні тіла протягом 20-60 хвилин. Введення препарату проводять із перервою на місяць. Карбоплатин розчиняють у стерильній водідля ін'єкцій: 5% розчин глюкози або ізотонічному розчині натрію хлориду. Термін придатності розчину становить 8 годин. Карбоплатин не використовують одночасно з препаратами, що мають нефротоксичну та нейротоксичну дію. Цей препарат платини для хіміотерапії застосовують лише під наглядом лікаря. Перед курсом лікування пацієнту проводять перевірку функціональних характеристик нирок та неврологічне обстеження. Вводять препарат за допомогою наборів та голок внутрішньовенного вливання з елементами алюмінію.
- Карбоплатин викликає побічні дії, які проявляються як пригнічення функції кровотворення, зменшення кількості тромбоцитів та лейкоцитів у крові, зниження гемоглобіну в крові, підвищення креатину та сечовини у крові. Препарат провокує появу нудоти, блювання, шкірні алергічні реакції, зниження слуху, ураження периферичних нервів, порушення чутливості, м'язову слабкість. Через використання Карбоплатину у пацієнтів можливе часткове або повне випадання волосся, озноб та гіпертермія.
- Препарат платини протипоказано застосовувати для пацієнтів з вираженими порушеннями функції нирок та підвищеною чутливістю до препаратів платини. Оскільки препарат здатний надавати канцерогенну дію, тобто викликати рак, то персонал, який працює з карбоплатином, повинен бути гранично обережним.
- Карбоплатин випускають у флаконах, як стерильний ліофілізований порошок для ін'єкцій. Препарат випускають у дозуванні по 0,05, 0,15, 0,2 та 0,45 г у флаконах. Карбоплатин випускають у формі розчину для ін'єкцій, в ампулах по 5, 15 і 45 мл.
Фенантриплатин
Новий експериментальний протипухлинний препарат. Цей лікарський засіб показав себе ефективніше, ніж препарат Цисплатин. Фенантриплатин повністю руйнує ракові клітини та перешкоджає виробленню резистентності до препаратів платини. Крім того, даний препарат охоплює ширший спектр онкозахворювань.
Фенантриплатин має низку переваг перед Цисплатином. Препарат легше і швидше проникає в ракові клітини та інгібує транскрипцію, тобто перетворює ДНК на РНК. У дослідженні препарату використовувалось понад 60 типів ракових клітин. Фенантриплатин показав ефективність у 40 разів вищу, ніж Цисплатин у боротьбі з раковими клітинами. Оскільки ракові клітини здатні формувати стійкість до дії препаратів, до складу фенантриплатину входить тричленне кільце, яке захищає платиновий препарат від атак з боку.
На сьогоднішній день препарат підтвердив свою ефективність у дослідах у лабораторіях. Тепер Фенантриплатин має випробувати на тваринах для підтвердження протипухлинної дії.
Препарати для печінки після хіміотерапії
Препарати печінки після хіміотерапії дозволяють відновити уражений орган. Печінку необхідно лікувати у обов'язковому порядку, оскільки під час хіміотерапії орган піддається сильній атаці важкими елементами, токсинами, які виводяться протягом тривалого часу. Печінка виконує декілька функцій. Орган бере активну участь в обміні речовин, надає захисну функцію, знешкоджуючи токсичні елементи, і виводить з організму різні речовини з жовчю, виконуючи функцію виділення. У період хіміотерапії на орган лягають додаткові функції. Печінка перетворює більшість лікарських препаратів на активну форму, знижуючи їх токсичну дію. Стан печінки впливає ефективність терапії. Так, захворювання органу надають токсичну та лікувальну дію на препарати. Усі препарати для хіміотерапії ушкоджують печінку.
Після курсу хіміотерапії на печінку лягає ще велике навантаження. Оскільки орган має зменшити токсичність препаратів. Тобто печінку необхідно захищати, підтримувати та відновлювати. Перед курсом хіміолікування лікар-онколог бере у пацієнта біохімічний аналіз крові. Це пов'язано з тим, що багато лікарських препаратів негативно впливають на орган і навіть можуть змінювати її будову. Деякі хіміопрепарати діють як прямі печінкові отрути, але їхня дія має прогнозований характер. Тому завдання лікаря вчасно призначити препарати для відновлення печінки після хіміотерапії. У будь-якому випадку, ступінь порушень функції печінки непередбачуваний і залежить не лише від дозування препаратів хімії, а й від індивідуальних особливостей організму хворого.
Печінкову недостатність через хіміотерапію виявити неважко, головне вчасно звернути увагу на таку симптоматику, як:
- Жовтизна шкірних покривів, слизових оболонок очей та порожнини рота.
- На шкірі з'являються крововиливи та судинні зірочки.
- При проведенні біохімічного аналізу лікарі відзначають різноманіття змін у крові.
Початковий ступінь ураження можна розпізнати лише за біохімічного аналізу крові. Саме тому, перед кожним курсом хіміотерапії кров пацієнта досліджують на ферменти та білірубін. При застосуванні високотоксичних препаратів хімії печінку починають захищати з перших днів лікування.
М'якими протекторами печінки, що відновлюють, є вітаміни групи В. Вітамін В12 (пангамат кальцію) призначають протягом усієї хіміотерапії. Препарат приймають по 2 таблетки 3 рази на день. Високі відновлювальні та захисні властивості має препарат Карсил. Препарат приймають по 1 таблетці 3 рази на добу. Полівітамінні комплекси – це ще один захист печінки. Вищеописані препарати призначають і тим онкохворим, які перенесли жовтяницю або страждали або страждають від хронічного алкоголізму.
Якщо перед черговим курсом хіміотерапії або в процесі лікування пацієнта виявляють ураження печінки, то хворому призначають Есенціалі. Цей препарат настільки популярний, що його популярність перевищує його ефективність та лікарські властивості. Препарат необхідно приймати протягом 2-4 місяців, а для отримання швидкого ефекту лікарський засіб вводиться внутрішньовенно 5-10 ін'єкцій. Препарати для відновлення печінки після хіміотерапії називаються гепатопротекторними лікарськими засобами, давайте розглянемо найефективніші з них:
Карсіл
Лікарський препарат, який застосовується для відновлення печінки після курсу хіміотерапії. Мембраностабілізуюча дія активної речовини препарату зменшує шкідливий вплив агресивних токсичних речовин на гепатоцити та знижує пошкодження клітин печінки. Препарат має антиоксидантні властивості та оптимізує метаболізм на клітинному рівні. Діюча речовина Карсил – силімарин, покращує загальний стан пацієнта (апетит, процеси травлення) та нормалізується клінічні аналізи. Виводиться препарат, як правило, нирками.
- Основні показання до застосування препарату – цирози печінки, а також хронічні гепатити вірусної та токсичної етіології. Карсил ефективний при відновленні печінки після курсу хіміотерапії та перенесених захворювань із ускладненнями на печінку.
- Лікарський засіб приймають від 1 до 4 разів на добу, залежно від індивідуальних потреб організму та тяжкості захворювання. При цьому курс лікування має становити щонайменше 90 днів.
- Побічні дії Карсил проявляються у вигляді диспепсії, вестибулярних порушень та алопеції. Вищеописана симптоматика відбувається самостійно, після відміни прийому препарату.
- Карсил протипоказано приймати при індивідуальній непереносимості компонентів препарату та при алергічних реакціях на складові лікарського засобу. Карсил можна комбінувати з іншими препаратами, оскільки немає даних про несприятливу взаємодію.
- При передозуванні препаратом можлива поява блювоти та нудоти. Для усунення несприятливої симптоматики необхідно промити шлунок, провести симптоматичну терапіюта прийняти сорбенти.
- Карсил випускають у таблетках. Препарат необхідно зберігати у захищеному від сонячного світла та недоступному для дітей місці. Температура зберігання має перевищувати 16-25 градусів. Препарат відпускається із аптек без рецепта лікаря.
Есенціалі
Ефективний печінковий препарат з активними речовинамиесенціальними фосфоліпідами. Діючі речовини беруть активну участь у регенарації, диференціації та розподілі клітин. Завдяки цьому препарат регулює проникність клітинної оболонки і покращує функції мембран. Фармакологічні властивості Есенціалі спрямовані на відновлення пошкоджених клітинпечінки, що покращує детоксикаційну функцію печінки, нормалізує її роботу.
- Основні показання до застосування препарату – гострі та хронічні гепатити, некроз та цироз клітин печінки, токсичні ураження, прекома та печінкова кома, жирова дегенерація, перед та післяопераційне лікування. Препарат ефективний при нейродермітах, радіаційному синдромі та псоріазі.
- Есенціалі випускають у формі капсул та ін'єкцій для внутрішньовенного введення. Капсули приймають три рази на добу по дві штуки як підтримуючу терапію. Що стосується внутрішньовенних ін'єкційто препарат вводять повільно, від 5 мл на добу до 20 мл у тяжких випадках. За один раз дозволяється вводити трохи більше 10 мл препарату. Ін'єкції проводять протягом 10 днів, після чого рекомендується продовжити парентеральну терапію капсулами Есенціалі. Курс лікування триває від 3 до 6 місяців.
- Побічна симптоматика проявляється при передозуванні. Есенціалі викликає шлунково-кишковий розладта нудоту. Лікування симптоматичне. Есенціалі протипоказано застосовувати для пацієнтів з підвищеною чутливістю до компонентів лікарського засобу. ], [
- Основні показання до застосування препарату: гострі, хронічні гепатити та гепатози, алкогольний стеатоз, отруєння токсинами, промисловими та медикаментозними отрутами. Лікування та відновлення печінки після хіміотерапії, неправильного харчування. Енерлів надає позитивний ефектпри неефективності немедикаментозних методів відновлення печінки
- Препарат приймають по дві капсули тричі на день, запиваючи великою кількістю води. Тривалість прийому препарату підбирається лікарем, індивідуально кожному за пацієнта.
- Енерлів проявляються у вигляді розладу шлунково-кишкового тракту, діареї, болю в епігастральній ділянці. У поодиноких випадках препарат викликає алергічні реакції (висип, кропив'янка, екзантема) та крововиливу (кровотечі в міжменструальний період, петехіальні висипання).
- Енерлів протипоказано приймати при індивідуальній непереносимості компонентів препарату, при алергії на сою та арахіс, при антифосфолідному синдромі в анамнезі. При взаємодії препарату з антикоагулянтами кумаринового ряду рекомендується коригувати дозування лікарських засобів, оскільки можливий синергізм дії.
Крім вищеописаних препаратів для відновлення печінки після хіміотерапії, регенеруючими властивостями для органу та оздоровлюючими для організму властивостями має дієта. Дієтичне харчування має на увазі відмову від смаженого, тушкованого, жирного та солодкого. Під заборону потрапляють жирні сортириби та м'яса, копченості, соління, ковбаса та інші продукти, багаті на холестерин. У період відновлення печінки категорично заборонено вживати гриби, ріпу, квасолю, горох, шпинат, цибулю та холодні напої.
Дієтологи та лікарі наголошують на вегетаріанський режим харчування. Хворому рекомендується їсти овочеві страви та супи, молочне. Корисними будуть м'ясні страви, приготовані на пару, нежирні сорти відварні м'яса, нежирна риба. Дозволяється вживати нежирний сир з медом, молоком та молочними продуктами, а також негострі сири. При будь-яких ураженнях печінки, а особливо в відновлювальний періодУ раціоні повинні бути стиглі ягоди, фрукти, сухофрукти, фруктово-ягідні соки, відвари, пшеничні висівки. При цьому добовий раціон повинен складатися з 90г білка, 80г жирів та 400г вуглеводів. Тобто добова калорійність має перевищувати 3000 кКал.
],
