Протипухлинних препаратів розрізняються, кожне з них проводиться для конкретно поставленої мети і підбирається під необхідні параметри для дослідження препарату. На даний момент виділяють такі види клінічних досліджень:
Відкрите та сліпе клінічне дослідження
Клінічне дослідження може бути відкритим та сліпим. Відкрите дослідження- це коли і лікар, та його пацієнт знають, який препарат досліджується. Сліпе дослідженняділиться на просте сліпе, подвійне сліпе дослідження та повне сліпе дослідження.
- Просте сліпе дослідження- це коли один бік не знає, який препарат досліджується.
- Подвійне сліпе дослідженняі повне сліпе дослідження- це коли дві або більше сторони не мають інформації щодо досліджуваного препарату.
Пілотне клінічне дослідженняпроводиться для отримання попередніх даних, важливих планування подальших етапів дослідження. Простою мовою можна було б назвати його «пристрілювальним». За допомогою пілотного дослідження визначається можливість проведення дослідження на більшій кількості піддослідних, розраховуються необхідні потужності та фінансові витрати на майбутнє дослідження.
Контрольоване клінічне дослідження- це порівняльне дослідження, в якому новий (досліджуваний) препарат, ефективність та безпека якого ще до кінця не вивчені, порівнюють зі стандартним способом лікування, тобто препаратом, що вже пройшов дослідження та вийшов на ринок.
Пацієнти у першій групі отримують терапію досліджуваним препаратом, пацієнти у другій – стандартним (ця група називається контрольної, звідси назва виду дослідження). Препаратом порівняння може бути як стандартна терапія, і плацебо.
Неконтрольоване клінічне дослідження- Це дослідження, в якому немає групи випробуваних, які приймають препарат порівняння. Зазвичай такий вид клінічних досліджень проводиться для препаратів із уже доведеною ефективністю та безпекою.
Рандомізоване клінічне дослідження- це дослідження, в якому пацієнти розподіляються на кілька груп (за видами лікування або схемою прийому препарату) випадковим чином і мають однакову можливість отримати досліджуваний або контрольний препарат (препарат порівняння або плацебо). У нерандомізованому дослідженніпроцедура рандомізації не проводиться, відповідно пацієнти не поділяються на окремі групи.
Паралельні та перехресні клінічні дослідження
Паралельні клінічні дослідження- це дослідження, при яких випробувані в різних групах отримують або тільки лікарський засіб, що вивчається, або тільки препарат порівняння. У паралельному дослідженні порівнюються кілька груп піддослідних, одна з яких отримує препарат, що досліджується, а інша група є контрольною. У деяких паралельних дослідженнях порівнюють різні види лікування без включення контрольної групи.
Перерекресні клінічні дослідження- Це дослідження, в яких кожен пацієнт отримує обидва порівнювані препарати, у випадковій послідовності.
Проспективне та ретроспективне клінічне дослідження
Проспективне клінічне дослідження- Це спостереження за групою хворих протягом тривалого часу, до настання результату (клінічно значущої події, яка служить об'єктом інтересу дослідника - ремісія, відповідь на лікування, виникнення рецидиву, летальний кінець). Таке дослідження є достовірним і тому проводиться найчастіше, причому у різних країнах одночасно, іншими словами, воно є міжнародним.
На відміну від проспективного дослідження, ретроспективне клінічне дослідження, Навпаки, вивчаються результати проведених раніше клінічних досліджень, тобто. результати наступають перед тим, як почалося дослідження.
Одноцентрове та багатоцентрове клінічне дослідження
Якщо клінічне дослідження проходить з урахуванням одного дослідницького центру, воно називається одноцентровим, а якщо на базі кількох, то багатоцентровим. Якщо ж дослідження проводиться в декількох країнах (як правило, центри розташовані в різних країнах), його називають міжнародним.
Когортне клінічне дослідження- Це дослідження, в якому виділену групу (когорту) учасників спостерігають протягом якогось часу. По закінченні цього часу результати дослідження порівнюються у піддослідних у різних підгрупах цієї когорти. З цих результатів робиться висновок.
У проспективному когортному клінічному дослідженні групи піддослідних становлять у час, а спостерігають у майбутньому. У ретроспективному клінічному когортному дослідженні групи піддослідних підбирають на підставі архівних даних і простежують їх результати по теперішній час.

Який вид клінічного дослідження буде найдостовірнішим?
Останнім часом фармацевтичні фірми зобов'язують проводити клінічні дослідження, при яких виходять найдостовірніші дані. Найчастіше задовольняє такі вимоги проспективне подвійне сліпе рандомізоване багатоцентрове плацебо-контрольоване дослідження. Це означає що:
- Проспективне– вестиметься спостереження протягом тривалого часу;
- Рандомізоване- Пацієнтів випадково розподілили по групах (зазвичай це робить спеціальна комп'ютерна програма, щоб в результаті відмінності між групами стали несуттєвими, тобто статистично недостовірними);
- Подвійне сліпе- ні лікар, ні пацієнт не знає, до якої групи пацієнт потрапив під час рандомізації, тому таке дослідження максимально об'єктивне;
- Багатоцентрове- Виконується відразу в декількох установах. Деякі види пухлин надзвичайно рідкісні (наприклад, наявність ALK-мутації при недрібноклітинному раку легені), тому в одному центрі складно знайти необхідну кількість пацієнтів, які відповідають критеріям включення до протоколу. Тому такі клінічні дослідження проводяться відразу в кількох дослідницьких центрах, причому, як правило, у кількох країнах одночасно і називаються міжнародними;
- Плацебо-контрольоване– учасники поділяються на дві групи, одні отримують досліджуваний препарат, інші – плацебо;
4
1 ГБОУ ВПО «Іванівський державний університет»
2 ФДАОУ ВПО "Московський фізико-технічний інститут (державний університет)" м. Довго- ставкий Московської області
3 ГБОУ ВПО «Іванівська ГМА» МОЗ РФ
4 ФДБОУ ВО «Іванівська державна медична академія» МОЗ РФ
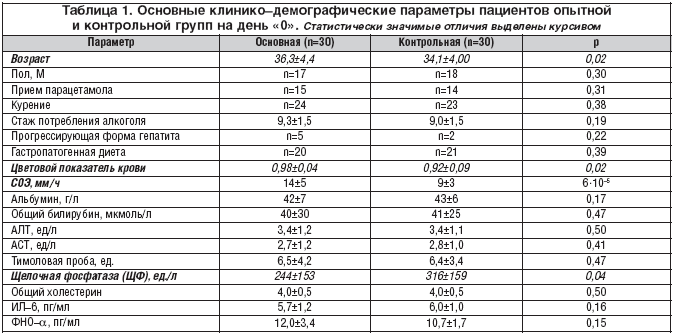
Для цитування:Єгорова Є.Ю., Юргель І.С., Назаренко О.А., Філософова М.С., Альпер І.А., Торшин І.Ю., Юдіна Н.В., Гришина Т.Р., Громова О .А. Рандомізоване контрольоване дослідження ефективності препарату Прогепар у пацієнтів із хронічним алкогольним гепатитом // РМЗ. 2011. №12. С. 753
Гепатопротектори розрізняються за механізмами та спектром свого фармакологічного впливу. У 2008 році в Росії в групі гепатопротекторних засобів (КодАТХ: А05ВА) зареєстровано препарат «Прогепар». У Німеччині та Японії цей препарат відомий як «Proheparum S.» Від раніше відомого препарату Prohepar відрізняється наявністю особливих синергідних компонентів (що і позначає літера S в назві препарату).







Література
1. Громова О.А., Торшин І.Ю., Юргель І.С. із співавт. Механізми дії та клінічна ефективність комбінованого гепатопротекторного препарату Прогепар. Важкий Пацієнт, 2009 №12.
2. Баяші А.О., Акіома Х., Тацакі Х. Вплив гідролізату печінки на циркуляцію крові при хронічних захворюваннях печінки // Арцнайміттель Форшунг, - 1972, 22С.578-580.
3. Fujisawa K., Suzuki H., Yamamoto S., Hirayama C., Shikata T., Sanbe R. Терапеутичні ефекти від хлоридної хлориду Prohepar в хронічній hepatitis - Двух-blind controlled study. Asian Med. J. 26(8):497-526
4. Демідов В.І., Назаренко О.А., Єгорова О.Ю. із співавт. Дослідження ефективності Прогепару при експериментальному пошкодженні печінки алкоголем та парацетамолом: біохімія та гістологія. Фарматека, 2011, №2.
5. Єгорова Є.Ю., Філософова М.С., Торшин І.Ю. із співавт. Порівняльна динаміка персистуючої та прогресуючої форм алкогольного гепатиту в курсі терапії препаратом Прогепар. Російський Медичний Журнал, Російський Медичний Журнал, Том 19, №2, 2011.
6. Федеральний закон від 12.04.2010 N 61-ФЗ «Про обіг лікарських засобів» www.government.ru.
7. Івашкін В.Т., Маєвська М.В. Алкогольно-вірусні захворювання печінки. – М.: Літтерра, 2007. – 160 с.
8. Громова О. А., Сатаріна Т. Є., Калачова А. Г., Ліманова О. А. Структурований опитувальник з оцінки дефіциту вітамінів. Раціоналізаторська пропозиція № 2461 від 17 листопада 2008 р.
9. Журавльов Ю. І. Вибрані наукові праці. - М: Магістр, 1998. - 420 с.
10. Журавльов Ю.І. Про алгебраїчному підході до вирішення завдань розпізнавання чи класифікації//Проблеми кібернетики: Вип.33.. - 1978. - с. 5-68.
11. Тогузов Р.Т., Шачнев Є.А., Назаренко О.А. із співавт. Зміст фолатів та ліпоївої кислоти в гепатопротекторі прогепар, Фарматека, 2011, 3
12. Ребров В.Г., Громова О.А. Вітаміни, макро- та мікроелементи. ГеотарМед, М., - 2008, 946 с.
13. Торшин І.Ю., Громова О.А. Фізіологічна модель взаємозв'язку вітаміну D3 з онкологічними захворюваннями та дані доказової медицини, Важкий пацієнт, 2008 №11, С. 21-26
14. Isoda K, Kagaya N, Akamatsu S, Hayashi S, Tamesada M, Watanabe A, Kobayashi M, Tagawa Y, Kondoh M, Kawase M, Yagi K. Hepatoprotective ефект vitamín B12 на dimethylnitrosamine-induced liver injury. Biol Pharm Bull. 2008 Feb;31(2):309-11.
Рандомізація є основним поняттям аналізу медичних даних.
Термін «рандомізація» стосується не вибірки, а способу її генерування.
Говорячи, що група цього розміру є простою випадковою вибіркою з більшої групи, ми маємо на увазі, що всі можливі вибірки цього розміру витягуються з рівними ймовірностями.
Говорячи, що обробка призначається об'єктам випадково, ми маємо на увазі, що можливість призначення кожного виду обробки однакова всім об'єктів.
На необхідність рандомізації вперше вказав Р. Фішер.
Рандомізація має три цілі:
гарантує, що наші переваги не вплинуть на формування груп з різними видами обробки
запобігає небезпеці, пов'язаній з вибором на основі особистих суджень
нарешті, при випадковому (рандомізованому) розподілі обробок найсуворіший критик не зможе сказати, що групи пацієнтів розглядалися по-різному внаслідок наших переваг
Рандомізація у клінічних випробуваннях
Припустимо, необхідно провести клінічні випробування лікарського засобу, щоб встановити його ефективність.
Для цього, наприклад, 50 хворим призначають ліки, а іншим 50 хворим призначають нейтральний препарат (пустушку),
Припустимо ще, що хворі надходять на випробування серіями протягом деякого часу, а не одночасно.
Розглянемо два методи рандомізації.
У першому методі потрібно вибрати 50 різних чисел між 1 і 100, активні ліки мають бути призначені тим із 100 хворих, чиї номери потрапили в цей набір. Інші 50 пацієнтів отримуватимуть нейтральний препарат.
Цей метод має два недоліки. По-перше, якщо доведеться передчасно завершити дослідження, то загальна кількість пацієнтів, які приймали активний препарат, з великою ймовірністю не дорівнюватиме кількості пацієнтів, які приймали нейтральний препарат.
Тим часом статистичні методи порівняння втрачають чутливість, якщо розміри вибірок різняться.
По-друге, якщо клінічний стан пацієнтів, що включаються в випробування в один момент часу, відрізняється від стану пацієнтів, що включаються в інший момент, або змінюються правила прийому препаратів, то, незважаючи на рандомізацію, дві групи, можливо, відрізнятимуться за типом пацієнтів або за правилами прийому ліків (див.).
Другий можливий метод рандомізації позбавлений недоліків, властивих першому.
З допомогою цього методу проводиться незалежна послідовна рандомізація пацієнтів, які у протягом коротких проміжків часу, за групами лікування.
Припустимо, що щомісяця у випробуваннях починають брати участь десять хворих.
Розумно випадково призначати п'яти пацієнтам лікування одного виду, а решті п'яти пацієнтам іншого, повторюючи випадкове призначення щомісяця, у міру надходження нових партій хворих.
Реалізацію цієї процедури можна здійснити, наприклад, за допомогою таблиці випадкових чисел, згенерованої в STATISTICA.
Вестимемо перегляд по десяти цифрах від 0 до 9, оскільки вибір ведеться з 10 хворих. Нулем позначимо десятого хворого.
Якщо ми почнемо з п'ятого стовпця, то першими п'ятьма різними цифрами виявляться 2, 5, 4, 8, 6. Отже, з десяти хворих на другий, п'ятий, четвертий, восьмий і шостий буде призначений активний, а решті — нейтральний препарат.
Продовжуючи переглядати таблицю, побачимо, що з наступних десяти хворих перший, третій, п'ятий, восьмий та десятий прийматимуть активний, а решта — нейтральний препарат. Використовуючи перші цифри у стовпці, можна продовжувати перегляд за іншими цифрами цього стовпця.
Для кожної наступної групи хворих слід отримувати новий набір випадкових чисел, щоб уникнути зсувів, які можуть з'явитися внаслідок прихованої періодичності типу хворих або через те, що співробітникам клініки незабаром буде зрозумілий вид ліків (він повинен бути невідомим співробітникам, які контактують з пацієнтами).
Окремий випадок цього методу – випробування на парах пацієнтів, коли один із двох пацієнтів отримує активний, а інший – нейтральний препарат.
І тут рандомізацію проводити дуже просто.
Спочатку якимось чином, наприклад, за алфавітним порядком прізвищ, виділяють одного з двох хворих як першого.
Цей вибір треба зробити до проведення рандомізації. Потім, починаючи з будь-якого зручного місця, переглядають однозначні числа таблиці випадкових чисел.
Якщо цифра непарна – 1, 3, 5, 7 чи 9, то перший хворий приймає активний, а другий – нейтральний препарат. Якщо цифра парна - 0, 2, 4, б або 8, активні ліки призначають другому хворому.
Однією з основних положень дизайну клінічного дослідження є рандомізація, тобто. процес випадкового розподілу варіантів досвіду між об'єктами Розподіл варіантів лікування у випадковому порядку не може бути досягнутий шляхом безладного відбору. Якщо у процесі відбору бере участь людина, ніяка схема відбору неспроможна вважатися по-справжньому випадковою. Відомо з практики, що й у учасників дослідження з'являється можливість проводити результати дослідження, цю можливість обов'язково буде використано. Завдання рандомізації якраз і полягає в тому, щоб забезпечити такий підбір хворих, при якому контрольна група відрізнялася від експериментальної лише методом лікування.
Слово «випадковість» у його звичайному розмовному сенсі застосовується до будь-якого методу вибору, який не має певної мети. Однак вибір, вироблений людиною, не є випадковим у строгому сенсі, оскільки на практиці він не вибирає однаково часто ті події, які є підставою вважати рівноймовірними.
Є лише один спосіб отримати процедуру істинно випадкового відбору - скористатися будь-яким незалежним від людини методом, наприклад, використовувати датчик (або таблицю) випадкових чисел.
Так, проста рандомізація ґрунтується на прямому застосуванні такої таблиці. Числа в таблиці випадкових чисел згруповані таким чином, щоб ймовірність для кожного з однозначних чисел в будь-якому місці таблиці була однакова (рівномірний розподіл). Крайній лівий стовпець таблиці є номерами рядків, верхній рядок - номери згрупованих по 5 стовпців. Довільно вибираються початкова точка (перетин рядка з якимсь номером і стовпця (або стовпців) залежно від того, скільки знаків має бути у випадкових числах, що витягуються) і напрямок руху. Кількість пацієнтів, яких необхідно розсортувати за групами, визначає, які числа будуть відбиратися: п< 10 лише однозначні числа; при і = 10-99 – двозначні і т.д. Наприклад, для розподілу 99 пацієнтів у три групи вибираємо вихідну точку на перетині довільного рядка та двох сусідніх стовпців, а також напрямок руху. Вибираємо двоцифрові числа. Зустрівши числа 1-33, розмістимо чергового пацієнта до першої групи, числа 34-66 - до другої групи, 67-99 - до третьої групи. Для розподілу на дві групи можна діяти так: зустрівши парні номери, відправляти чергового пацієнта до першої групи, а непарні - до другої. Однак такий метод може призвести до формування різних за чисельністю груп.
Від цього недоліку вільний метод послідовні номери. Кожному пацієнту надають номер, що є випадковим числом таблиці випадкових чисел. Потім ці номери ранжуються в порядку зростання і відповідно до обраного правила розподіляють методи лікування. Наприклад, для розподілу на дві групи: парні номери ранжированному ряду - перша група, непарні - друга. Однак кількість пацієнтів у групах врівноважується лише до кінця процедури рандомізації.
Метод адаптивної рандомізації підтримує рівну кількість пацієнтів у групах протягом усієї процедури рандомізації. Загалом така процедура передбачає наступне: на початку лікування пацієнти розподіляються рівноймовірно, потім перед тим, як визначити, до якої групи віднести чергового пацієнта, оцінюється чисельність вже створених на даний момент груп. Якщо чисельність груп однакова, лікування розподіляють рівноймовірно, якщо чисельність однієї з груп перевищує іншу, ймовірність потрапити до цієї групи знижується.
Добре зберігає рівну чисельність груп протягом усього процесу рандомізації та метод блочної рандомізації. Хворих, яких передбачається включити у дослідження, умовно поділяють на рівні блоки. У межах блоку методи лікування розподіляються так, щоб різними методами лікувалося однакове число пацієнтів, але послідовність призначення лікування була б різною. Потім блоки випадково розподіляють, наприклад, користуючись таблицею випадкових чисел.
Рандомізовані контрольовані клінічні випробування (РКІ), проводяться у стаціонарах, рідше в інших ЛПЗ з метою оцінки потенційної ефективності засобів, способів та схем лікування, діагностики, хвороб.
При оцінці потенційної ефективності препарату, запропонованого для лікування будь-якої хвороби, популяцією є хворі з однаковим клінічним перебігом цієї хвороби, порівняно однакової статі та віку та іншими ознаками, які можуть впливати на результат хвороби.
Вибірка формується з урахуванням певних обмежень, у своїй хворі, які мають популяцію, не потрапляють у вибірку в основному з таких причин:
не відповідність критеріям відбору за факторами, які можуть вплинути на передбачуваний ефект експериментального лікування;
відмова брати участь у експерименті;
передбачувана можливість недотримання окремими особами умов експерименту (наприклад, нерегулярний прийом призначеного препарату, порушення правил оборотності тощо);
протипоказання до експериментального лікування.
В результаті такого відбору сформована вибірка може виявитися нечисленною, що позначиться на результатах оцінки достовірності відмінностей частоти результатів у дослідній та контрольній групі. Крім того, сформована вибірка може бути різко зміщена і навіть достовірні дані матимуть суттєві обмеження під час поширення результатів на всю популяцію хворих.
Рандомізація в РКД повинна забезпечити сумісність груп за різними ознаками і, головне, за ознаками, що впливають на результат хвороби . Однак цього можна досягти лише за досить великих вибірок, сформувати які не завжди можливо. При малій кількості хворих, сумісність груп, як правило, порушується внаслідок того, що частина осіб, з різних причин, вибуває з експерименту, що може перешкоджати отриманню достовірних висновків.
Мал. 7. Рандомізоване контрольоване випробування для оцінки результатів ранньої виписки з лікарні пацієнтів, які перенесли інфаркт міокарда.Джерело. Основи епідеміології. Р Біглхол із співавт. ВООЗ, Женева, 1994.
Наведені дані (рис. 7) показують, як із різних причин різко скоротилася кількість пацієнтів, що беруть участь в експерименті. У результаті результати статистичної обробки виявилися не достовірними, і за даними цього дослідження тільки орієнтовно можна вважати, що рання виписка (через 3 дні) безпечна для осіб, які перенесли інфаркт міокарда.
За зниженням надійності методи рандомізації, що застосовуються в РКІ, найчастіше розподіляють у такому порядку:
централізована рандомізація телефоном незалежним фахівцем статистиком, або представником фармацевтичної фірми.
метод закодованих (пронумерованих) однакових контейнерів, що постачаються фармацевтичною фірмою, при цьому код та вміст контейнерів невідомі ні хворим, ні лікарям, які беруть участь у дослідженні;
централізований комп'ютерний метод - комп'ютерна програма генерує випадкову послідовність розподілу пацієнтів за групами, подібну до послідовності в таблиці випадкових чисел, при цьому поділ хворих на групи порівняння проводиться спеціалістом, який бере участь лише у процесі рандомізації.
метод непрозорих, запечатаних та пронумерованих конвертів. Вказівки про необхідне втручання містяться в конверти, послідовно пронумеровані згідно з таблицею випадкових чисел. Вкрай важливо, щоб конверти розкривали тільки після того, як у приймальному відділенні дослідник запише на них прізвище хворого та інші необхідні дані;
Незалежно від методу, рандомізація може бути простий та стратифікований (Існують і інші, рідше використовувані види рандомізації). У разі простої рандомізації додаткові фактори не враховуються, а кожен пацієнт має шанс 50 на 50 потрапити до тієї чи іншої групи. Стратифікована рандомізація (виділення підгруп – страт) застосовується у випадках, коли неможливо створити групи з однаковим прогнозом результату досвіду у випробуваних осіб. Наприклад, якщо результат дослідження може вплинути одне із заданих параметрів (вік, рівень артеріального тиску, перенесений інфаркт міокарда та інших.) пацієнтів спочатку ділять на підгрупи. Далі у кожній підгрупі групі проводять рандомізацію. Деякі фахівці вважають стратифіковану рандомізацію недостатньо коректною.
Незважаючи на виняткову важливість інформації про метод рандомізації для оцінки читачем надійності результатів дослідження, різні автори наводять практично однакові оцінки досліджень за цим параметром. Встановлено, що у 80 - 90-х роках лише у 25 - 35% звітів про РКИ, опублікованих у спеціалізованих журналах, й у 40 - 50% звітів, опублікованих у загальномедичних журналах, повідомлялося застосування правильного методу генерації випадкової послідовності включення учасників до групи . Майже у всіх випадках використовувалися або комп'ютерний генератор, або таблиця випадкових чисел. При аналізі статей, опублікованих в одному з журналів з дерматології за 22 роки, було встановлено, що застосування правильного методу генерації випадкової послідовності повідомлялося лише в 1 з 68 звітів про РКИ.
Найважливіший елемент організації РКІ засобів лікування - використання методу засліплення (маскування). Як зазначалося в попередньому розділі, перевага надається подвійному і навіть потрійному сліпому дослідженню, оскільки хворі або медичний персонал, що бере участь у випробуванні, мимоволі чи навмисно, можуть спотворити дані та вплинути цим на результат дослідження.
Маскування втручань від хворих є важливим, тому що результат застосовуваного впливу значною мірою залежить від психологічного стану пацієнта. При відкритості інформації хворі дослідної групи можуть або невиправдано сподіватися на сприятливий результат лікування, або, навпаки, переживати з приводу того, що погодилися бути «піддослідними кроликами». Хворі контрольної групи також можуть поводитися по-різному, наприклад, почуватись обділеними, особливо якщо вони вважатимуть, що в дослідній групі процес лікування більш успішний. Різне психологічний стан хворих може призвести до цілеспрямованих пошуків ними ознак поліпшення або навпаки погіршення стану їхнього здоров'я, що неминуче позначиться на оцінці стану, зміни якого нерідко виявляються уявними. Маскування від лікаря-дослідника необхідне, оскільки він може бути свідомо переконаний у перевагах випробуваного засобу та суб'єктивно трактувати зміни стану здоров'я випробуваних.
Необхідність подвійного маскування об'єктивно підтверджує ефект плацебо. Плацебо – лікарська форма, яка не відрізняється від досліджуваного препарату за зовнішнім виглядом, кольором, смаком та запахом, але не має специфічної дії, або іншого байдужого втручання, що використовується в медичних дослідженнях для імітації лікування з метою усунення систематичної помилки, пов'язаної з плацебо-ефектом. Плацебо-ефект – зміна стану пацієнта (відзначається самим пацієнтом або лікарем), пов'язана тільки з фактом лікування, а не з біологічною дією препарату.
Численними дослідженнями встановлено, що деякі хворі (залежно від хвороби до 1/3), приймаючи плацебо за ліки, реагують на нього так само, або майже так само, як і хворі дослідної групи. Вивчення ефекту плацебо дозволяє виділити специфічні складові нового лікування Крім того, якщо хворі не знають, до якої групи вони належать, вони більш точно дотримуються правил експерименту.
Як згадувалося у попередньому розділі, для підвищення надійності висновків вводять третє засліплення на етапі статистичної обробки даних доручаючи ці дії незалежним особам.
«Сліпі» клінічні дослідження не використовуються в оцінці потенційної ефективності хірургічних втручань, методів фізіотерапії, дієт, багатьох діагностичних процедур тощо., тобто. у випадках, коли замаскувати вплив неможливо, чи недоцільно ні хворих, ні лікарів. У таких випадках рандомізовані дослідження називають відкритими.
Після закінчення встановленого часу спостереження проводять статистичну обробку виявлених результатів (ефектів впливу) хвороби у дослідній та контрольній групі. Для того щоб уникнути систематичну помилку, критерії результату хвороби в дослідній та контрольній групах хворих мають бути специфічними та однаковими. Для підвищення надійності висновків дослідження нерідко проводять не одномоментно, а протягом деякого періоду, включаючи в нього хворих, що знову надходять.
Для статистичної обробки отриманих даних застосовується та сама таблиця «два на два».

Таблиця 11. Макет таблиці "два на два" для оцінки результатів експериментальних досліджень.
Більшість показників, що оцінюють ефективність експериментального впливу в клінічних та польових випробуваннях, хоч і мають інші назви (так історично склалося), відповідають і за способом розрахунку та за змістом величинам, що розраховуються в когортних дослідженнях.
Для кількісного вираження ефективності використовують різні статистичні показники, у своїй відсутня сувора уніфікація їх назв.
1.
Показник відносної ефективності (
показник ефективності
):

Ця величина відповідає відносному ризику, що обчислюється в когортних дослідженнях . Показник ефективності визначає у скільки разів , Частота позитивних результатів впливу в дослідній групі вище, ніж їх частота в контрольній групі, тобто. у скільки разів новий спосіб лікування, діагностики та ін, краще, ніж зазвичай використовується.
Для інтерпретації показника ефективності використовуються оцінні критерії. відносного ризику (Див. статистичну обробку даних когортного дослідження). При цьому відповідно змінюється зміст формулювань, оскільки оцінюється не фактор ризику хвороби, а ефективність застосовуваного експериментального впливу.
2. Атрибутивний (додатковий) ефект відповідає атрибутивному (додатковому) ризику, що визначається в когортних дослідженнях.

Розмір атрибутивного ефекту показує на скільки ефект від експериментального впливу більший, ніж ефект від впливу в контрольній групі;
3 . Частка ефекту впливу (частка ефективності) відповідає етіологічній частці обчислюваної при аналізі даних когортних досліджень.

Ця величина показує частку позитивних результатів, що належить експериментальному впливу, у сумі позитивних ефектів у дослідній групі.
4. додаткова величина, яку назвали - кількість хворих, яких необхідно лікувати (ЧБНЛ) для запобігання одному несприятливому результату.

Чим більший цей показник, тим менша потенційна ефективність досліджуваного впливу.
Так само, як і при обробці даних когортних досліджень, достовірність даних в експериментах оцінюється за допомогою критерію «хі-квадрат» або іншими методами.
На закінчення відзначимо, що, незважаючи на всі переваги, рандомізовані клінічні випробування ховають у собі можливість систематичної помилки, особливо помилки пов'язаної з формуванням вибірки. Отже, результати одного дослідження, навіть бездоганного щодо організації, не можуть розглядатися як безумовна рекомендація застосування нового препарату у клінічній практиці. Саме тому нині надійними вважаються лише результати багатоцентрових досліджень ефективності одного й того ж втручання (лікування) декількома клініками, бажано, щоб дослідження проводилися в клініках різних країнах.

