Medicamentele antineoplazice diferă, fiecare dintre ele se efectuează în scopuri specifice și este selectat pentru parametrii necesari pentru studiul medicamentului. În prezent, se disting următoarele tipuri de studii clinice:
Studiu clinic deschis și orb
Cercetările clinice pot fi deschise și orbe. Cercetare deschisă- acesta este momentul în care atât medicul cât și pacientul său știu ce medicament este investigat. Explorare oarbăîmpărțit în cercetare simplu-orb, dublu-orb și complet orb.
- Explorare oarbă simplă- atunci când o parte nu știe ce medicament este investigat.
- Studiu dublu orbși explorare complet orb este atunci când două sau mai multe părți nu au informații despre drogul de investigație.
Studiu clinic pilot se realizează pentru a obține date preliminare importante pentru planificarea etapelor ulterioare ale studiului. În limbaj simplu, s-ar putea numi „observare”. Cu ajutorul unui studiu pilot, se determină posibilitatea efectuării unui studiu pe un număr mai mare de subiecți, se calculează capacitățile necesare și costurile financiare pentru cercetările viitoare.
Studiu clinic controlat este un studiu comparativ în care un medicament nou (de investigație), a cărui eficacitate și siguranță nu a fost încă studiată pe deplin, este comparat cu o metodă de tratament standard, adică un medicament care a trecut deja de cercetare și a intrat pe piață.
Pacienții din primul grup primesc terapie medicamentoasă de studiu, pacienții din al doilea primesc terapie standard (acest grup se numește Control, de unde și numele tipului de studiu). Medicamentul de referință poate fi fie terapia standard, fie placebo.
Studiu clinic necontrolat- Acesta este un studiu în care nu există un grup de subiecți care iau un medicament de comparație. De obicei, acest tip de cercetare clinică se efectuează pentru medicamente cu eficacitate și siguranță deja dovedite.
Studiu clinic randomizat- este un studiu în care pacienții sunt repartizați aleatoriu în mai multe grupuri (după tipul de tratament sau regim de medicamente) și au aceeași oportunitate de a primi studiul sau medicamentul de control (medicament de comparație sau placebo). V studiu nerandomizat procedura de randomizare nu este efectuată, prin urmare, pacienții nu sunt împărțiți în grupuri separate.
Studii clinice paralele și încrucișate
Studii clinice paralele- Acestea sunt studii în care subiecții din diferite grupuri primesc fie numai medicamentul studiat, fie numai medicamentul de referință. Un studiu paralel compară mai multe grupuri de subiecți, unul primind medicamentul studiat și celălalt fiind grupul de control. Unele studii paralele compară diferite tratamente fără a include un grup de control.
Studii clinice transversale- Acestea sunt studii în care fiecare pacient primește ambele medicamente comparate, într-o secvență aleatorie.
Studiu clinic prospectiv și retrospectiv
Studiu clinic prospectiv- Aceasta este observarea unui grup de pacienți pentru o lungă perioadă de timp, înainte de debutul rezultatului (un eveniment semnificativ clinic care servește ca obiect de interes al cercetătorului - remisie, răspuns la tratament, apariția recidivelor, deces). Un astfel de studiu este cel mai fiabil și, prin urmare, este realizat cel mai des și în diferite țări în același timp, cu alte cuvinte, este internațional.
Spre deosebire de studiul prospectiv, în studiu clinic retrospectiv dimpotrivă, rezultatele studiilor clinice anterioare sunt studiate; rezultatele apar înainte de începerea studiului.
Studiu clinic monocentric și multicentric
Dacă se efectuează un studiu clinic la un centru de cercetare, acesta se numește unic-centru, și dacă se bazează pe mai multe, atunci multicentric... Cu toate acestea, dacă studiul se desfășoară în mai multe țări (de regulă, centrele sunt situate în diferite țări), se numește internaţional.
Studiu clinic de cohortă Este un studiu în care un grup selectat (cohorta) de participanți este observat în timp. La sfârșitul acestui timp, rezultatele studiului sunt comparate la subiecți din diferite subgrupuri ale cohortei date. O concluzie se face pe baza acestor rezultate.
Într-un studiu clinic de cohortă prospectiv, grupurile de subiecți sunt compuse în prezent și observate în viitor. Într-un studiu clinic de cohortă retrospectiv, grupurile de subiecți sunt selectate pe baza datelor istorice și rezultatele lor sunt urmărite până în prezent.

Ce tip de studiu clinic va fi cel mai fiabil?
Recent, companiile farmaceutice sunt obligate să efectueze studii clinice în care cele mai fiabile date... Cel mai adesea îndeplinește aceste cerințe studiu prospectiv, dublu-orb, randomizat, multicentric, controlat cu placebo... Înseamnă că:
- Prospectiv- va fi monitorizat mult timp;
- Randomizat- pacienții au fost repartizați aleatoriu în grupuri (de obicei, acest lucru se face printr-un program special de computer, astfel încât, în cele din urmă, diferențele dintre grupuri devin nesemnificative, adică nesigure din punct de vedere statistic);
- Dublu orb- nici medicul, nici pacientul nu știu în ce grup a căzut pacientul în timpul randomizării, prin urmare, un astfel de studiu este cât se poate de obiectiv;
- Multicentric- efectuat în mai multe instituții simultan. Unele tipuri de tumori sunt extrem de rare (de exemplu, prezența unei mutații ALK în cancerul pulmonar cu celule mici), deci este dificil să se găsească numărul necesar de pacienți într-un centru care îndeplinesc criteriile de includere în protocol. Prin urmare, astfel de studii clinice sunt efectuate simultan în mai multe centre de cercetare, în plus, de regulă, în mai multe țări în același timp și sunt numite internaționale;
- Controlat cu placebo- Participanții sunt împărțiți în două grupuri, unii primesc medicamentul studiat, alții un placebo;
4
1 GBOU VPO „Universitatea de Stat Ivanovo”
2 FGAOU VPO „Institutul de Fizică și Tehnologie din Moscova (Universitatea de Stat)”, Dolgoprudny, Regiunea Moscova
3 Instituția de învățământ bugetar de stat pentru învățământul profesional superior „Ivanovskaya GMA” din Ministerul Sănătății al Federației Ruse
4 FSBEI HE „Academia de stat Ivanovo” a Ministerului Sănătății al Federației Ruse
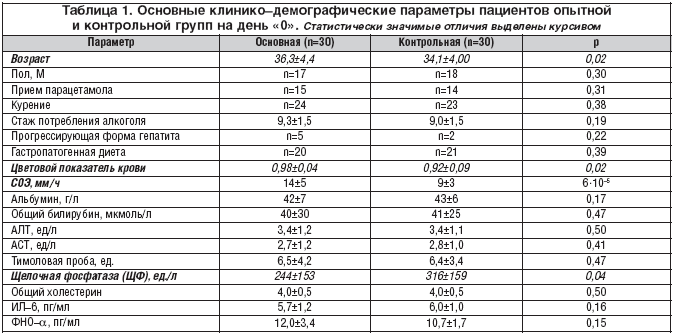
Pentru citare: Egorova E.Yu., Yurgel I.S., Nazarenko O.A., Filosofova M.S., Alper I.A., Torshin I.Yu., Yudina N.V., Grishina T.R., Gromova O .A. Un studiu controlat randomizat al eficacității Prohepar la pacienții cu hepatită alcoolică cronică // BC. 2011. Nr. 12. P. 753
Introducere Hepatoprotectorii diferă prin mecanismele și spectrul efectelor lor farmacologice. În 2008, medicamentul „Prohepar” a fost înregistrat în Rusia în grupul agenților hepatoprotectori (CodeATC: A05VA). În Germania și Japonia, acest medicament este cunoscut sub numele de „Proheparum S.” Se diferențiază de medicamentul cunoscut anterior „Prohepar” prin prezența componentelor sinergice speciale (care este indicată de litera „S” în numele medicamentului).







Literatură
1. Gromova O.A., Torshin I.Yu., Yurgel I.S. și colab. Mecanisme de acțiune și eficacitate clinică a medicamentului hepatoprotector combinat Prohepar. Pacient dificil, 2009, nr.12.
2. Bayashi AO, Akioma H., Tatsaki H. Efectul hidrolizatului hepatic asupra circulației sângelui în bolile hepatice cronice // Artsnaimittel Forshung, - 1972, 22S.578-580.
3. Fujisawa K., Suzuki H., Yamamoto S., Hirayama C., Shikata T., Sanbe R. Efecte terapeutice ale hidrolizatului hepatic Prohepar în hepatita cronică - Un studiu dublu-orb controlat. Mediatic asiatic J. 26 (8): 497-526
4. Demidov V.I., Nazarenko O.A., Egorova E.Yu. și colab. Investigarea eficacității Prohepar în afectarea hepatică experimentală cu alcool și paracetamol: biochimie și histologie. Pharmateca, 2011, nr. 2.
5. Egorova E.Yu., Filosofova M.S., Torshin I.Yu. și colab. Dinamica comparativă a formelor persistente și progresive ale hepatitei alcoolice în cursul terapiei cu Prohepar. Russian Medical Journal, Russian Medical Journal, volumul 19, nr. 2, 2011.
6. Legea federală din 12.04.2010 N 61-FZ „Cu privire la circulația medicamentelor” www.government.ru.
7. Ivashkin V.T., Mayevskaya M.V. Alcool-boli hepatice virale. - M.: Litterra, 2007 .-- 160 p.
8. Gromova O. A., Satarina T. E., Kalacheva A. G., Limanova O. A. Chestionar structurat pentru a evalua deficitul de vitamine. Propunerea de raționalizare nr. 2461 din 17 noiembrie 2008
9. Zhuravlev Yu. I. Lucrări științifice selectate. - M.: Magister, 1998 .-- 420 p.
10. Zhuravlev Yu.I. Pe o abordare algebrică a rezolvării problemelor de recunoaștere sau clasificare // Probleme de cibernetică: problema 33 .. - 1978. - p. 5-68.
11. Toguzov R.T., Shachnev E.A., Nazarenko O.A. și colab. Conținutul de folat și acid lipoic în hepatoprotector prohepar, Pharmateca, 2011, 3
12. Rebrov V.G., Gromova O.A. Vitamine, macro și microelemente. GeotarMed, M., - 2008, 946 p.
13. Torshin I.Yu., Gromova O.A. Model fiziologic al relației vitaminei D3 cu cancerul și datele medicamentoase bazate pe dovezi, pacient dificil, 2008, nr. 11, pp. 21-26
14. Isoda K, Kagaya N, Akamatsu S, Hayashi S, Tamesada M, Watanabe A, Kobayashi M, Tagawa Y, Kondoh M, Kawase M, Yagi K. Efectul hepatoprotector al vitaminei B12 asupra leziunilor hepatice induse de dimetilnitrosamină. Biol Pharm Bull. 2008 februarie; 31 (2): 309-11.
Randomizarea este un concept cheie în analiza datelor medicale.
Termenul „randomizare” nu se referă la un eșantion, ci la modul în care este generat.
Spunând că un grup de o dimensiune dată este un eșantion simplu aleatoriu dintr-un grup mai mare, înseamnă că toate probele posibile de acea dimensiune sunt extrase cu probabilități egale.
Când spunem că procesarea este atribuită obiectelor la întâmplare, înseamnă că probabilitatea de a atribui fiecare tip de procesare este aceeași pentru toate obiectele.
Nevoia randomizării a fost subliniată pentru prima dată de R. Fisher.
Randomizarea are trei scopuri:
se asigură că preferințele noastre nu afectează formarea grupurilor cu diferite tipuri de tratament
previne pericolul asociat cu alegerile bazate pe judecata personală
în cele din urmă, având în vedere o distribuție aleatorie (randomizată) a tratamentelor, cel mai strict critic nu ar putea spune că grupurile de pacienți au fost tratați diferit din cauza preferințelor noastre
Randomizarea în studiile clinice
Să presupunem că trebuie să efectuați studii clinice ale unui medicament pentru a determina eficacitatea acestuia.
Pentru aceasta, de exemplu, 50 de pacienți primesc un medicament, iar altor 50 de pacienți li se prescrie un medicament neutru („manechin”),
Să presupunem, de asemenea, că pacienții sunt internați pentru testare în serie, pe o perioadă de timp și nu simultan.
Să luăm în considerare două metode de randomizare.
În prima metodă, trebuie selectate 50 de numere diferite între 1 și 100, medicamentul activ trebuie atribuit celor din 100 de pacienți ale căror numere sunt incluse în acest set. Restul de 50 de pacienți vor primi un medicament neutru.
Această metodă are două dezavantaje. În primul rând, dacă studiul trebuie încheiat prematur, este puțin probabil ca numărul total de pacienți care iau medicamentul activ să fie egal cu numărul de pacienți care iau medicamentul neutru.
Cu toate acestea, metodele de comparație statistică devin mai puțin sensibile dacă dimensiunile eșantionului diferă.
În al doilea rând, dacă starea clinică a pacienților care intră în studiu la un moment dat diferă de starea pacienților care intră într-un alt moment sau regulile de administrare a medicamentului se schimbă, atunci, în ciuda randomizării, cele două grupuri pot diferi în tipul de pacienți sau conform regulilor de administrare a medicamentelor (vezi).
A doua metodă posibilă de randomizare nu are dezavantajele primei.
Această metodă randomizează în mod independent secvențial pacienții internați pe perioade scurte de timp în grupurile de tratament.
Să presupunem că zece pacienți încep un studiu în fiecare lună.
Este prudent să alocați aleatoriu cinci pacienți un tip de tratament și ceilalți cinci pacienți altul, repetând repartizarea aleatorie în fiecare lună pe măsură ce sosesc noi loturi de pacienți.
Implementarea acestei proceduri poate fi realizată, de exemplu, folosind un tabel de numere aleatorii generate în STATISTICA.
Vom efectua o revizuire cu zece cifre de la 0 la 9, deoarece alegerea se face din 10 pacienți. Să desemnăm al zecelea pacient ca zero.
Dacă începem cu a cincea coloană, atunci primele cinci numere diferite vor fi 2, 5, 4, 8, 6. Deci, din zece pacienți, al doilea, al cincilea, al patrulea, al optulea și al șaselea vor primi un medicament activ, iar restul - un medicament neutru.
Continuând să ne uităm la masă, vom vedea că din următorii zece pacienți, primul, al treilea, al cincilea, al optulea și al zecelea vor lua un medicament activ, iar restul vor lua un medicament neutru. După ce utilizați primele cifre dintr-o coloană, puteți continua să răsfoiți cele două cifre ale acelei coloane.
Pentru fiecare grup ulterior de pacienți, ar trebui obținut un nou set de numere aleatorii pentru a evita prejudecăți care pot apărea datorită periodicității latente a tipului de pacienți sau datorită faptului că personalul clinicii va înțelege în curând tipul de medicament (nu ar trebui să fie cunoscut de personalul în contact cu pacienții).
Un caz special al acestei metode este testarea pe perechi de pacienți, atunci când unul dintre cei doi pacienți primește un medicament activ, iar celălalt un medicament neutru.
În acest caz, randomizarea este foarte ușoară.
În primul rând, într-un fel, de exemplu, în ordinea alfabetică a numelor de familie, unul dintre cei doi pacienți este ales ca primul.
Această alegere trebuie făcută înainte de randomizare. Apoi, pornind de la orice loc convenabil, se uită prin numerele dintr-o singură cifră din tabelul numerelor aleatorii.
Dacă numărul este impar - 1, 3, 5, 7 sau 9, atunci primul pacient ia un medicament activ, iar al doilea ia un medicament neutru. Dacă cifra este pare - 0, 2, 4, b sau 8, medicamentul activ este prescris celui de-al doilea pacient.
Unul dintre principiile principale ale proiectării studiilor clinice este randomizarea, adică procesul de distribuire aleatorie a opțiunilor de experiență printre obiecte. Opțiunile de tratament aleatorii nu pot fi realizate prin selecție aleatorie. Dacă o persoană este implicată în procesul de selecție, nicio schemă de selecție nu poate fi considerată cu adevărat aleatorie. Din practică se știe că, dacă participanții la cercetare au posibilitatea de a influența rezultatele cercetării, această oportunitate va fi cu siguranță folosită. Sarcina randomizării este tocmai de a asigura o astfel de selecție de pacienți în care grupul de control ar diferi de grupul experimental doar în metoda de tratament.
Cuvântul „șansă” în sensul său colocvial obișnuit se aplică oricărei metode de alegere care nu are un scop specific. Cu toate acestea, alegerea făcută de o persoană nu este întâmplătoare în sens strict, deoarece în practică nu alege la fel de des acele evenimente pe care există motive să le considerăm la fel de probabile.
Există o singură modalitate de a obține o procedură de selecție cu adevărat aleatorie - de a utiliza o metodă independentă de o persoană, de exemplu, utilizați un generator (sau un tabel) de numere aleatorii.
Asa de, simplu randomizarea se bazează pe aplicarea directă a unui astfel de tabel. Numerele din tabelul numerelor aleatorii sunt grupate în așa fel încât probabilitatea ca fiecare dintre numerele dintr-o singură cifră să fie oriunde în tabel este aceeași (distribuție uniformă). Coloana din stânga a tabelului este numerele rândurilor, rândul superior este numerele grupate pe 5 coloane. Punctul de plecare (intersecția unui rând cu un anumit număr și o coloană (sau coloane), în funcție de câte caractere ar trebui să fie în numerele aleatorii extrase) și direcția de mișcare sunt selectate în mod arbitrar. Numărul de pacienți care urmează să fie sortați în grupuri determină ce numere vor fi selectate: NS< 10 reprezintă doar numere dintr-o singură cifră; pentru u = 10-99 - două cifre etc. De exemplu, pentru a distribui 99 de pacienți în trei grupuri, selectăm punctul de plecare la intersecția unui rând arbitrar și a două coloane adiacente, precum și direcția de mișcare. Alegem numere din două cifre. După ce am întâlnit numerele 1-33, vom plasa următorul pacient în primul grup, numerele 34-66 - în al doilea grup, 67-99 - în al treilea grup. Pentru distribuirea în două grupuri, puteți acționa după cum urmează: când întâlniți numere pare, trimiteți următorul pacient la primul grup, iar cei impari la al doilea. Cu toate acestea, această metodă poate duce la formarea de grupuri de diferite dimensiuni.
Metoda numere consecutive. Fiecărui pacient i se atribuie un număr care este un număr aleatoriu dintr-un tabel de numere aleatorii. Aceste numere sunt apoi clasificate în ordine crescătoare, iar tratamentele sunt alocate în conformitate cu regula selectată. De exemplu, pentru distribuirea în două grupuri: numere pare în rândul clasat - primul grup, numere impare - al doilea. Cu toate acestea, numărul pacienților din grupuri este echilibrat doar spre sfârșitul procedurii de randomizare.
Metodă randomizare adaptivă menține un număr egal de pacienți în grupuri pe parcursul întregii proceduri de randomizare. În general, o astfel de procedură presupune următoarele: la începutul tratamentului, pacienții sunt distribuiți la fel de probabil, apoi, înainte de a determina grupului căruia i se atribuie următorul pacient, se estimează numărul grupurilor deja create în acest moment. Dacă numărul grupurilor este același, tratamentul este distribuit la fel de probabil, dacă numărul unuia dintre grupuri îl depășește pe celălalt, probabilitatea de a intra în acest grup scade.
Păstrează dimensiuni egale ale grupurilor pe tot parcursul procesului și metodei de randomizare blocarea randomizării. Pacienții care ar trebui incluși în studiu sunt împărțiți în mod convențional în blocuri egale. În cadrul blocului, metodele de tratament sunt distribuite astfel încât același număr de pacienți să fie tratați cu metode diferite, dar secvența prescripției tratamentului ar fi diferită. Apoi blocurile sunt alocate aleatoriu, de exemplu folosind un tabel de numere aleatorii.
Studii clinice controlate randomizate (ECA), sunt efectuate în spitale, mai rar în alte instituții medicale, pentru a evalua eficacitatea potențială a mijloacelor, metodelor și schemelor de tratament, diagnostic, boli.
Atunci când se evaluează eficacitatea potențială a unui medicament propus pentru tratamentul unei boli, populația este formată din pacienți cu același curs clinic al acestei boli, comparativ cu același sex și vârstă și alte semne care pot afecta rezultatul bolii.
Eșantionul este format ținând cont de anumite restricții, în timp ce pacienții care reprezintă populația, neincluse în eșantion în principal din următoarele motive:
nerespectarea criteriilor de selecție pentru factorii care pot afecta efectul scontat al tratamentului experimental;
refuzul de a participa la experiment;
presupusa posibilitate de nerespectare de către indivizi a condițiilor experimentului (de exemplu, consumul neregulat de medicament prescris, încălcarea regulilor de apel etc.);
contraindicații la tratamentul experimental.
Ca urmare a unei astfel de selecții, eșantionul format se poate dovedi a fi mic, ceea ce va afecta rezultatele evaluării fiabilității diferențelor în frecvența rezultatelor în grupurile experimentale și de control. În plus, eșantionul format poate fi dramatic strămutat și chiar datele fiabile vor avea limitări semnificative în extinderea rezultatelor la întreaga populație de pacienți.
Randomizare într-un RCT ar trebui să asigure comparabilitatea grupurilor din diferite motive și, cel mai important, prin semne care afectează rezultatul bolii ... Cu toate acestea, acest lucru poate fi realizat numai cu probe suficient de mari, care nu sunt întotdeauna posibile să se formeze. Cu un număr mic de pacienți, comparabilitatea grupurilor, de regulă, este încălcată ca urmare a faptului că unele persoane, din diverse motive, abandonează experimentul, ceea ce poate împiedica tragerea unor concluzii fiabile.
Orez. 7. Un studiu controlat randomizat pentru a evalua rezultatele externării precoce la spital la pacienții cu infarct miocardic. Sursa. Fundamentele epidemiologiei. R Bighole și colab. OMS, Geneva, 1994.
Datele prezentate (Fig. 7) arată cum, din diverse motive, numărul pacienților care participă la experiment a scăzut brusc. Ca rezultat, rezultatele procesării statistice s-au dovedit a fi nesigure și, conform datelor acestui studiu, se poate crede foarte puțin că descărcarea timpurie (după 3 zile) este sigură pentru persoanele care au avut infarct miocardic.
Scăderea fiabilității Metodele de randomizare utilizate în RCT sunt cel mai adesea clasificate în următoarea ordine:
randomizare centralizată prin telefon de către un statistician independent sau un reprezentant al unei companii farmaceutice.
metoda containerelor identice codificate (numerotate) furnizate de o companie farmaceutică, în timp ce codul și conținutul containerelor nu sunt cunoscute nici pacientului, nici medicilor care participă la studiu;
metodă computerizată centralizată - un program de computer generează o secvență aleatorie de distribuție a pacienților în grupuri, similară secvenței dintr-un tabel de numere aleatorii, în același timp, împărțirea pacienților în grupuri de comparație este realizată de un specialist care participă doar la procesul de randomizare.
metoda plicurilor opace, sigilate și numerotate. Instrucțiunile de intervenție sunt plasate în plicuri numerotate secvențial în conformitate cu un tabel de numere aleatorii. Este extrem de important ca plicurile să fie deschise numai după ce cercetătorul scrie numele pacientului și alte date necesare asupra acestora în secția de admitere;
Indiferent de metodă, randomizarea poate fi simplă și stratificată (există alte tipuri de randomizare mai puțin utilizate). În cazul randomizării simple, nu se iau în considerare factori suplimentari și fiecare pacient are 50/50 șanse să intre într-unul sau alt grup. Randomizarea stratificată (selecția subgrupurilor - straturi) este utilizată în cazurile în care este imposibil să se creeze grupuri cu același prognostic al rezultatului experienței la subiecți. De exemplu, dacă unul dintre parametrii specificați (vârsta, nivelul tensiunii arteriale, infarctul miocardic etc.) poate afecta rezultatul cercetării, pacienții sunt mai întâi împărțiți în subgrupuri. Mai mult, în fiecare subgrup, grupul este randomizat. Unii experți consideră că randomizarea stratificată nu este suficient de corectă.
În ciuda importanței extreme a informațiilor despre metoda de randomizare pentru evaluarea cititorului a fiabilității rezultatelor studiului, diferiți autori dau aproape aceleași estimări ale studiilor asupra acestui parametru. S-a constatat că, în anii 80-90, doar 25 - 35% din rapoartele despre ECA publicate în reviste specializate și 40 - 50% din rapoartele publicate în reviste medicale generale, au raportat utilizarea metodei corecte de generare a unei secvențe aleatorii de includere a participanților la grupuri ... În aproape toate aceste cazuri, s-a folosit fie un generator de calculator, fie un tabel de numere aleatorii. Într-o analiză de 22 de ani a articolelor publicate într-un jurnal de dermatologie de peste 22 de ani, doar 1 din 68 de rapoarte RCT au raportat folosind metoda corectă de secvențiere aleatorie.
Cel mai important element al organizării ECA a mijloacelor de tratament este utilizarea metodei de orbire (mascare). După cum sa menționat în secțiunea anterioară, testul dublu și chiar triplu-orb este preferat, deoarece pacienții sau personalul medical care participă la proces, în mod involuntar sau deliberat, pot distorsiona datele și, prin urmare, pot afecta rezultatul cercetării.
Mascarea intervențiilor de la pacienți este importantă, deoarece rezultatul expunerii aplicate depinde în mare măsură de starea psihologică a pacientului. Odată cu deschiderea informațiilor, pacienții din grupul experimental pot spera, în mod nejustificat, la un rezultat favorabil al tratamentului sau, dimpotrivă, își pot face griji cu privire la faptul că au acceptat să fie „iepuri experimentali”. Pacienții din grupul de control se pot comporta, de asemenea, diferit, de exemplu, se simt lipsiți, mai ales dacă consideră că procesul de tratament are mai mult succes în grupul experimentat. O stare psihologică diferită a pacienților poate duce la o căutare intenționată a semnelor de îmbunătățire sau, dimpotrivă, la o deteriorare a sănătății lor, care va afecta inevitabil propria evaluare a stării, ale cărei modificări sunt adesea imaginare. Este necesară deghizarea de la cercetătorul medical, deoarece acesta poate fi convins în mod deliberat de beneficiile medicamentului testat și poate interpreta subiectiv modificările stării de sănătate a subiecților.
Nevoia de mascare dublă confirmă în mod obiectiv „efectul placebo”. Placebo - O formă de dozare care nu se distinge de medicamentul de studiu prin aspect, culoare, gust și miros, dar neavând un efect specific sau altă intervenție indiferentă utilizată în cercetarea medicală pentru a simula tratamentul în scopul eliminării prejudecății asociate cu efectul placebo. Efectul placebo este o modificare a stării pacientului (notată de pacientul însuși sau de medicul curant) asociată doar cu faptul tratamentului și nu cu efectul biologic al medicamentului.
Numeroase studii au descoperit că unii pacienți (în funcție de boală până la 1/3), luând un placebo pentru un medicament, reacționează la acesta în același mod sau aproape în același mod ca pacienții din grupul experimental. Studiul efectului placebo vă permite să vă izolați specific componentele noului tratament. În plus, dacă pacienții nu știu din ce grup aparțin, respectă mai îndeaproape regulile experimentului.
După cum s-a menționat în secțiunea anterioară, pentru a îmbunătăți fiabilitatea concluziilor, introduceți a treia orbire în etapa procesării datelor statistice, încredințând aceste acțiuni unor persoane independente.
Nu se utilizează studii clinice „orb” la evaluarea potențialei eficacități a intervențiilor chirurgicale, a metodelor de fizioterapie, a dietelor, a multor proceduri de diagnostic etc. în acele cazuri în care este imposibil să mascați impactul sau este inadecvat fie pentru pacienți, fie pentru medici. În astfel de cazuri, sunt numite studiile randomizate deschis.
După ce a trecut timpul de observație specificat, se efectuează prelucrarea statistică a rezultatelor identificate (efectele expunerii) bolii în grupurile experimentale și de control. Pentru a evita părtinirea, criteriile pentru rezultatul bolii în grupurile experimentale și de control ale pacienților ar trebui să fie specifice și aceleași. Pentru a crește fiabilitatea concluziilor, studiul este adesea efectuat nu simultan, ci pentru o anumită perioadă, inclusiv pacienții nou-internați.
Pentru prelucrarea statistică a datelor obținute, se utilizează același tabel „doi câte doi”.

Tabelul 11. Structura tabelului „doi câte doi” pentru evaluarea rezultatelor studiilor experimentale.
Majoritatea indicatorilor care evaluează eficacitatea expunerii experimentale în studiile clinice și de teren, deși au nume diferite (așa cum sa întâmplat istoric), corespund atât în metoda de calcul, cât și în sens cu valorile calculate în studiile de cohortă.
Se utilizează diverși indicatori statistici pentru a cuantifica eficacitatea, în timp ce nu există o unificare strictă a numelor lor.
1.
Indicatorul de eficiență relativă (
indicator de performanta
):

Această valoare corespunde riscului relativ calculat în studiile de cohortă. ... Indicatorul de performanță determină De câte ori , frecvența rezultatelor pozitive ale expunerii în grupul experimental este mai mare decât frecvența lor în grupul de control, adică De câte ori o nouă metodă de tratament, diagnostic etc., mai bună decât cea frecvent utilizată.
Criteriile de evaluare sunt utilizate pentru interpretarea indicatorului de performanță. risc relativ (a se vedea prelucrarea statistică a datelor studiului cohortei). În acest caz, în consecință, semnificația formulărilor se modifică, deoarece nu se evaluează factorul de risc al bolii, ci eficacitatea influenței experimentale aplicate.
2. Efect atributiv (suplimentar) , corespunde riscului atributiv (suplimentar) determinat în studiile de cohortă.

Mărimea efectului atributiv arată cât costă efectul expunerii experimentale este mai mare decât efectul expunerii în grupul de control;
3 . Proporția impactului (proporția eficacității) corespunde proporției etiologice calculate în analiza datelor din studiile de cohortă.

Această valoare arată proporția rezultatelor pozitive aparținând efectului experimental în suma efectelor pozitive din grupul experimental.
4. o cantitate suplimentară numită - numărul de pacienți care urmează să fie tratați (NNT) pentru a preveni un rezultat advers.

Cu cât acest indicator este mai mare, cu atât este mai mică eficiența potențială a impactului studiat.
La fel ca în procesarea datelor din studiile de cohortă, fiabilitatea datelor obținute în experimente este evaluată folosind testul chi-pătrat sau alte metode.
În concluzie, observăm că, în ciuda tuturor avantajelor, studiile clinice randomizate sunt pline de posibilitatea unei părtiniri, în special a unei părtiniri prin eșantionare. În consecință, rezultatele unui studiu, chiar impecabil în organizație, nu pot fi considerate o recomandare necondiționată pentru utilizarea unui medicament nou în practica clinică. Acesta este motivul pentru care, în prezent, doar rezultatele sunt considerate fiabile. studii multicentrice eficacitatea aceleiași intervenții (tratament) de către mai multe clinici, în timp ce este de dorit ca studiile să fie efectuate în clinici din diferite țări.

