Les médicaments antinéoplasiques diffèrent, chacun d'eux est utilisé à des fins spécifiques et est sélectionné pour les paramètres nécessaires à l'étude du médicament. À l'heure actuelle, on distingue les types d'essais cliniques suivants :
Essai clinique ouvert et aveugle
La recherche clinique peut être ouverte et aveugle. Recherche ouverte- c'est à ce moment que le médecin et son patient savent quel médicament est à l'étude. Exploration à l'aveugle est divisé en recherche en simple aveugle, en double aveugle et en aveugle.
- Exploration simple à l'aveugle- c'est lorsqu'une partie ne sait pas quel médicament fait l'objet d'une enquête.
- Étude en double aveugle et exploration complète à l'aveugle c'est lorsque deux ou plusieurs parties n'ont pas d'informations sur le médicament expérimental.
Étude clinique pilote est effectuée pour obtenir des données préliminaires importantes pour la planification des étapes ultérieures de l'étude. En langage clair, on pourrait l'appeler "observation". A l'aide d'une étude pilote, la possibilité de mener une étude sur un plus grand nombre de sujets est déterminée, les capacités nécessaires et les coûts financiers pour les recherches futures sont calculés.
Essai clinique contrôlé est une étude comparative dans laquelle un nouveau médicament (d'investigation), dont l'efficacité et l'innocuité n'ont pas encore été entièrement étudiées, est comparé à une méthode de traitement standard, c'est-à-dire un médicament qui a déjà fait l'objet de recherches et est entré sur le marché.
Les patients du premier groupe reçoivent un traitement médicamenteux à l'étude, les patients du second reçoivent un traitement standard (ce groupe est appelé contrôler, d'où le nom du type d'étude). Le médicament de référence peut être soit un traitement standard, soit un placebo.
Essai clinique non contrôlé- Il s'agit d'une étude dans laquelle il n'y a pas de groupe de sujets prenant un médicament de comparaison. Habituellement, ce type de recherche clinique est effectué pour des médicaments dont l'efficacité et l'innocuité ont déjà été prouvées.
Essai clinique randomisé- une étude dans laquelle les patients sont randomisés en plusieurs groupes (par type de traitement ou schéma thérapeutique) et ont la même possibilité de recevoir le médicament à l'étude ou de contrôle (médicament de comparaison ou placebo). V étude non randomisée la procédure de randomisation n'est pas effectuée, respectivement, les patients ne sont pas divisés en groupes séparés.
Essais cliniques parallèles et croisés
Essais cliniques parallèles- Il s'agit d'études dans lesquelles des sujets de différents groupes reçoivent soit uniquement le médicament étudié, soit uniquement le médicament de référence. Une étude parallèle compare plusieurs groupes de sujets, l'un recevant le médicament à l'étude et l'autre étant le groupe témoin. Certaines études parallèles comparent différents traitements sans inclure de groupe témoin.
Essais cliniques transversaux- Il s'agit d'études dans lesquelles chaque patient reçoit les deux médicaments comparés, dans un ordre aléatoire.
Étude clinique prospective et rétrospective
Essai clinique prospectif- Il s'agit de l'observation d'un groupe de patients pendant longtemps, avant l'apparition de l'issue (un événement cliniquement significatif qui sert d'objet d'intérêt au chercheur - rémission, réponse au traitement, survenue de rechute, décès). Une telle étude est la plus fiable et est donc réalisée le plus souvent, et dans différents pays à la fois, c'est-à-dire qu'elle est internationale.
Contrairement à l'étude prospective, dans étude clinique rétrospective au contraire, les résultats des essais cliniques précédents sont à l'étude ; les résultats se produisent avant le début de l'étude.
Essai clinique monocentrique et multicentrique
Si un essai clinique est mené dans un centre de recherche, il est appelé monocentre, et si basé sur plusieurs, alors multicentre... Si, toutefois, l'étude est menée dans plusieurs pays (en règle générale, les centres sont situés dans des pays différents), elle est appelée international.
Étude clinique de cohorte Est une étude dans laquelle un groupe sélectionné (cohorte) de participants est observé au fil du temps. A la fin de ce temps, les résultats de l'étude sont comparés chez des sujets dans différents sous-groupes de la cohorte donnée. Une conclusion est faite sur la base de ces résultats.
Dans une étude clinique de cohorte prospective, des groupes de sujets sont composés dans le présent et observés dans le futur. Dans une étude clinique de cohorte rétrospective, des groupes de sujets sont sélectionnés sur la base de données historiques et leurs résultats sont suivis jusqu'à aujourd'hui.

Quel type d'essai clinique sera le plus fiable ?
Récemment, les sociétés pharmaceutiques sont obligées de mener des essais cliniques dans lesquels les données les plus fiables... Répond le plus souvent à ces exigences étude prospective, en double aveugle, randomisée, multicentrique, contrôlée contre placebo... Cela signifie que:
- Éventuel- sera surveillé pendant longtemps ;
- Randomisé- les patients ont été répartis au hasard dans des groupes (généralement cela est fait par un programme informatique spécial, de sorte qu'à la fin les différences entre les groupes deviennent insignifiantes, c'est-à-dire statistiquement non fiables);
- Double aveugle- ni le médecin ni le patient ne savent dans quel groupe le patient appartenait lors de la randomisation, une telle étude est donc la plus objective possible ;
- Multicentre- joué dans plusieurs institutions à la fois. Certains types de tumeurs sont extrêmement rares (par exemple, la présence d'une mutation ALK dans le cancer du poumon non à petites cellules), il est donc difficile de trouver le nombre nécessaire de patients dans un même centre qui répondent aux critères d'inclusion dans le protocole. Par conséquent, de tels essais cliniques sont menés à la fois dans plusieurs centres de recherche, de plus, en règle générale, dans plusieurs pays à la fois et sont appelés internationaux;
- Contrôlé par placebo- Les participants sont répartis en deux groupes, certains reçoivent le médicament à l'étude, d'autres un placebo ;
4
1 GBOU VPO "Université d'Etat d'Ivanovo"
2 FGAOU VPO "Institut de Physique et de Technologie de Moscou (Université d'Etat)", Dolgoprudny, Région de Moscou
3 Établissement d'enseignement public d'enseignement professionnel supérieur "Ivanovskaya GMA" du ministère de la Santé de la Fédération de Russie
4 FSBEI HE "Ivanovo State Medical Academy" du ministère de la Santé de la Fédération de Russie
Pour citer : Egorova E.Yu., Yurgel I.S., Nazarenko O.A., Filosofova M.S., Alper I.A., Torshin I.Yu., Yudina N.V., Grishina T.R., Gromova O .A. Un essai contrôlé randomisé de l'efficacité de Prohepar chez les patients atteints d'hépatite alcoolique chronique // BC. 2011. N° 12. P.753
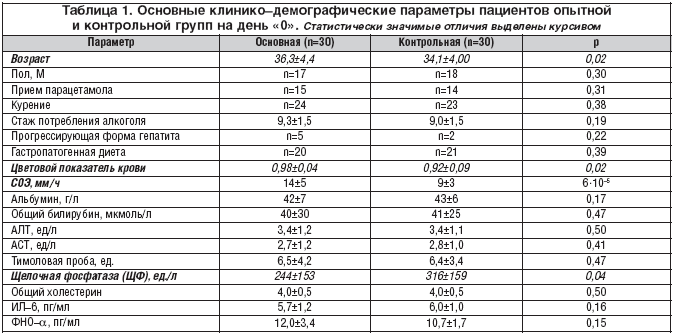
Introduction Les hépatoprotecteurs diffèrent par leurs mécanismes et le spectre de leurs effets pharmacologiques. En 2008, le médicament "Prohepar" a été enregistré en Russie dans le groupe des agents hépatoprotecteurs (CodeATC : A05VA). En Allemagne et au Japon, ce médicament est connu sous le nom de "Proheparum S". Il diffère du médicament précédemment connu "Prohepar" par la présence de composants synergiques spéciaux (indiqués par la lettre "S" dans le nom du médicament).







Littérature
1. Gromova O.A., Torshin I.Yu., Yurgel I.S. et al. Mécanismes d'action et efficacité clinique du médicament hépatoprotecteur combiné Prohepar. Patient Difficile, 2009, n° 12.
2. Bayashi AO, Akioma H., Tatsaki H. Effet de l'hydrolysat du foie sur la circulation sanguine dans les maladies chroniques du foie // Artsnaimittel Forshung, - 1972, 22S.578-580.
3. Fujisawa K., Suzuki H., Yamamoto S., Hirayama C., Shikata T., Sanbe R. Effets thérapeutiques de l'hydrolysat hépatique Prohepar dans l'hépatite chronique - Une étude contrôlée en double aveugle. Med asiatique. J. 26 (8) : 497-526
4. Demidov V.I., Nazarenko O.A., Egorova E.Yu. et al. Etude de l'efficacité de Prohepar dans les atteintes hépatiques expérimentales avec l'alcool et le paracétamol : biochimie et histologie. Pharmateca, 2011, n°2.
5. Egorova E.Yu., Filosofova M.S., Torshin I.Yu. et al. Dynamique comparée des formes persistantes et évolutives d'hépatite alcoolique au cours d'un traitement par Prohepar. Journal médical russe, Journal médical russe, Volume 19, n° 2, 2011.
6. Loi fédérale du 12.04.2010 N 61-FZ "sur la circulation des médicaments" www.government.ru.
7. Ivashkin V.T., Mayevskaya M.V. Maladies hépatiques virales alcooliques. - M. : Litterra, 2007 .-- 160 p.
8. Gromova O. A., Satarina T. E., Kalacheva A. G., Limanova O. A. Questionnaire structuré pour évaluer la carence en vitamines. Proposition de rationalisation n°2461 du 17 novembre 2008
9. Zhuravlev Yu. I. Travaux scientifiques sélectionnés. - M. : Magister, 1998.-- 420 p.
10. Zhuravlev Yu.I. Sur une approche algébrique pour résoudre des problèmes de reconnaissance ou de classification // Problèmes de Cybernétique : Numéro 33 .. - 1978. - p. 5-68.
11. Toguzov R.T., Shachnev E.A., Nazarenko O.A. et al. Teneur en folate et en acide lipoïque dans l'hépatoprotecteur prohepar, Pharmateca, 2011, 3
12. Rebrov V.G., Gromova O.A. Vitamines, macro et microéléments. GeotarMed, M., - 2008, 946 p.
13. Torshin I. Yu., Gromova O.A. Modèle physiologique de la relation de la vitamine D3 avec le cancer et données de médecine factuelle, Patient difficile, 2008, n° 11, pp. 21-26
14. Isoda K, Kagaya N, Akamatsu S, Hayashi S, Tamesada M, Watanabe A, Kobayashi M, Tagawa Y, Kondoh M, Kawase M, Yagi K. Effet hépatoprotecteur de la vitamine B12 sur les lésions hépatiques induites par la diméthylnitrosamine. Taureau Biol Pharm. 31 février 2008 (2) : 309-11.
La randomisation est un concept clé dans l'analyse des données médicales.
Le terme « randomisation » ne fait pas référence à un échantillon, mais à la façon dont il est généré.
En disant qu'un groupe d'une taille donnée est un échantillon aléatoire simple d'un groupe plus grand, nous voulons dire que tous les échantillons possibles de cette taille sont tirés avec des probabilités égales.
Quand on dit que le traitement est affecté aux objets au hasard, nous entendons que la probabilité d'affecter chaque type de traitement est la même pour tous les objets.
La nécessité d'une randomisation a été signalée pour la première fois par R. Fisher.
La randomisation a trois objectifs :
veille à ce que nos préférences n'affectent pas la formation de groupes avec différents types de traitement
prévient le danger associé aux choix fondés sur le jugement personnel
enfin, étant donné une distribution aléatoire (randomisée) des traitements, le critique le plus strict ne pourrait pas dire que les groupes de patients ont été traités différemment en raison de nos préférences
Randomisation dans les essais cliniques
Supposons que vous ayez besoin de mener des essais cliniques sur un médicament pour déterminer son efficacité.
Pour cela, par exemple, 50 patients se voient prescrire un médicament, et 50 autres patients se voient prescrire un médicament neutre ("factice"),
Supposons également que les patients soient admis au test en série, sur une période de temps, et non simultanément.
Considérons deux méthodes de randomisation.
Dans la première méthode, 50 nombres différents entre 1 et 100 doivent être sélectionnés, le médicament actif doit être attribué à ceux des 100 patients dont les nombres sont inclus dans cet ensemble. Les 50 patients restants recevront un médicament neutre.
Cette méthode présente deux inconvénients. Premièrement, si l'étude doit être interrompue prématurément, il est peu probable que le nombre total de patients prenant le médicament actif soit égal au nombre de patients prenant le médicament neutre.
Pendant ce temps, les méthodes de comparaison statistique deviennent moins sensibles si les tailles d'échantillon diffèrent.
Deuxièmement, si l'état clinique des patients entrant dans l'essai à un moment donné diffère de l'état des patients entrant à un autre moment, ou si les règles d'administration du médicament changent, alors, malgré la randomisation, les deux groupes peuvent différer. selon le type de patients ou selon les règles de prise de médicaments (voir).
La deuxième méthode de randomisation possible ne présente pas les inconvénients de la première.
Cette méthode randomise de manière séquentielle et indépendante les patients admis sur de courtes périodes de temps dans des groupes de traitement.
Supposons que dix patients commencent l'essai chaque mois.
Il est prudent d'assigner au hasard cinq patients à un type de traitement et les cinq autres patients à un autre, en répétant l'assignation aléatoire chaque mois à mesure que de nouveaux lots de patients arrivent.
La mise en œuvre de cette procédure peut être effectuée, par exemple, à l'aide d'une table de nombres aléatoires générés dans STATISTIQUE.
Nous procéderons à une revue par dix chiffres de 0 à 9, puisque le choix se fait à partir de 10 patients. Désignons le dixième patient comme zéro.
Si nous commençons par la cinquième colonne, les cinq premiers nombres différents seront 2, 5, 4, 8, 6. Ainsi, sur dix patients, les deuxième, cinquième, quatrième, huitième et sixième se verront attribuer un médicament actif, et le reste - un médicament neutre.
En continuant à regarder le tableau, nous verrons que sur les dix prochains patients, le premier, le troisième, le cinquième, le huitième et le dixième prendront un médicament actif, et les autres prendront un médicament neutre. Après avoir utilisé les premiers chiffres d'une colonne, vous pouvez continuer à parcourir les deuxièmes chiffres de cette colonne.
Pour chaque groupe de patients suivant, un nouvel ensemble de nombres aléatoires doit être obtenu afin d'éviter les biais pouvant apparaître en raison de la périodicité latente du type de patients ou du fait que le personnel de la clinique comprendra bientôt le type de médicament. (il ne doit pas être connu du personnel en contact avec les patients).
Un cas particulier de cette méthode est le test sur des paires de patients, lorsque l'un des deux patients reçoit un médicament actif et l'autre - un médicament neutre.
Dans ce cas, la randomisation est très facile.
Premièrement, d'une certaine manière, par exemple, dans l'ordre alphabétique des noms de famille, l'un des deux patients est désigné comme le premier.
Ce choix doit être fait avant la randomisation. Puis, à partir de n'importe quel endroit convenable, ils parcourent les nombres à un chiffre dans le tableau des nombres aléatoires.
Si le nombre est impair - 1, 3, 5, 7 ou 9, alors le premier patient prend un médicament actif et le second prend un médicament neutre. Si le chiffre est pair - 0, 2, 4, b ou 8, le médicament actif est prescrit au deuxième patient.
L'un des principes fondamentaux de la conception des essais cliniques est la randomisation, c'est-à-dire le processus de distribution aléatoire des options d'expérience entre les objets. La randomisation des options de traitement ne peut pas être obtenue par sélection aléatoire. Si une personne est impliquée dans le processus de sélection, aucun schéma de sélection ne peut être considéré comme véritablement aléatoire. On sait par la pratique que si les participants à la recherche ont la possibilité d'influencer les résultats de la recherche, cette opportunité sera certainement utilisée. La tâche de la randomisation est précisément d'assurer une telle sélection de patients dans laquelle le groupe témoin ne différerait du groupe expérimental que par la méthode de traitement.
Le mot "chance" dans son sens familier habituel s'applique à toute méthode de choix qui n'a pas d'objectif spécifique. Cependant, le choix fait par une personne n'est pas aléatoire au sens strict, puisqu'en pratique il ne choisit pas aussi souvent les événements qu'il y a lieu de considérer comme également probables.
Il n'y a qu'une seule façon d'obtenir une procédure de sélection vraiment aléatoire - utiliser une méthode indépendante d'une personne, par exemple, utiliser un générateur (ou une table) de nombres aléatoires.
Donc, Facile la randomisation est basée sur l'application directe d'un tel tableau. Les nombres du tableau des nombres aléatoires sont regroupés de telle sorte que la probabilité pour chacun des nombres à un chiffre d'être n'importe où dans le tableau soit la même (distribution uniforme). La colonne la plus à gauche du tableau est les numéros de ligne, la ligne du haut est les numéros regroupés par 5 colonnes. Le point de départ (l'intersection d'une ligne avec un certain nombre et une colonne (ou des colonnes), selon le nombre de caractères devant être dans les nombres aléatoires extraits) et la direction du mouvement sont choisis arbitrairement. Le nombre de patients à trier en groupes détermine quels numéros seront sélectionnés : N.-É.< 10 n'est que des nombres à un chiffre ; pour u = 10-99 - deux chiffres, etc. Par exemple, pour répartir 99 patients en trois groupes, nous sélectionnons le point de départ à l'intersection d'une ligne arbitraire et de deux colonnes adjacentes, ainsi que le sens du mouvement. Nous choisissons des nombres à deux chiffres. Ayant rencontré les numéros 1-33, nous placerons le prochain patient dans le premier groupe, les numéros 34-66 - dans le deuxième groupe, 67-99 - dans le troisième groupe. Pour une répartition en deux groupes, vous pouvez procéder comme suit : lorsque vous rencontrez des nombres pairs, envoyez le patient suivant dans le premier groupe, et les impairs dans le second. Cependant, cette méthode peut conduire à la formation de groupes de tailles différentes.
La méthode nombres consécutifs. Chaque patient se voit attribuer un numéro qui est un nombre aléatoire d'une table de nombres aléatoires. Ces numéros sont ensuite classés par ordre croissant et les traitements sont attribués selon la règle choisie. Par exemple, pour une distribution en deux groupes : nombres pairs dans la ligne classée - le premier groupe, nombres impairs - le second. Cependant, le nombre de patients dans les groupes n'est équilibré que vers la fin de la procédure de randomisation.
Méthode randomisation adaptative maintient un nombre égal de patients dans les groupes pendant toute la procédure de randomisation. En général, une telle procédure suppose ce qui suit : au début du traitement, les patients sont répartis de manière égale, puis, avant de déterminer à quel groupe affecter le prochain patient, le nombre de groupes déjà créés à ce moment est estimé. Si le nombre de groupes est le même, le traitement est distribué également probable, si le nombre d'un des groupes dépasse l'autre, la probabilité d'entrer dans ce groupe diminue.
Maintient une taille bien égale des groupes tout au long du processus et de la méthode de randomisation bloquer la randomisation. Les patients censés être inclus dans l'étude sont classiquement divisés en blocs égaux. Au sein du bloc, les méthodes de traitement sont réparties de manière à ce qu'un même nombre de patients soient traités avec des méthodes différentes, mais la séquence de prescription de traitement serait différente. Ensuite, les blocs sont alloués aléatoirement, par exemple à l'aide d'une table de nombres aléatoires.
Essais cliniques contrôlés randomisés (ECR), sont effectuées dans les hôpitaux, moins souvent dans d'autres établissements de santé afin d'évaluer l'efficacité potentielle des moyens, des méthodes et des schémas de traitement, de diagnostic, de maladies.
Lors de l'évaluation de l'efficacité potentielle d'un médicament proposé pour le traitement d'une maladie, la population se compose de patients présentant la même évolution clinique de cette maladie, comparativement le même sexe et le même âge, et d'autres signes pouvant affecter l'issue de la maladie.
L'échantillon est constitué en tenant compte de certaines restrictions, tandis que les patients représentant la population, non inclus dans l'échantillon principalement pour les raisons suivantes :
non-respect des critères de sélection des facteurs pouvant affecter l'effet attendu du traitement expérimental ;
refus de participer à l'expérience;
la possibilité alléguée de non-respect par les individus des conditions de l'expérience (par exemple, prise irrégulière du médicament prescrit, violation des règles d'appel, etc.);
contre-indications au traitement expérimental.
À la suite d'une telle sélection, l'échantillon formé peut s'avérer petit, ce qui affectera les résultats de l'évaluation de la fiabilité des différences dans la fréquence des résultats dans les groupes expérimental et témoin. De plus, l'échantillon formé peut être considérablement déplacé et même des données fiables auront des limites importantes pour étendre les résultats à l'ensemble de la population de patients.
Randomisation dans un ECR devrait assurer la comparabilité des groupes pour divers motifs et, plus important encore, par des signes qui affectent l'issue de la maladie ... Cependant, cela ne peut être réalisé qu'avec des échantillons suffisamment grands, qui ne sont pas toujours possibles à former. Avec un petit nombre de patients, la comparabilité des groupes est généralement violée du fait que certaines personnes, pour diverses raisons, abandonnent l'expérience, ce qui peut empêcher de tirer des conclusions fiables.
Riz. 7. Un essai contrôlé randomisé pour évaluer les résultats de la sortie précoce de l'hôpital chez les patients atteints d'infarctus du myocarde.Source. Fondements de l'épidémiologie. R Bighole et al. OMS, Genève, 1994.
Les données présentées (Fig. 7) montrent comment, pour diverses raisons, le nombre de patients participant à l'expérience a fortement diminué. En conséquence, les résultats du traitement statistique se sont avérés non fiables, et selon les données de cette étude, il n'est que très provisoirement possible de supposer qu'une sortie précoce (après 3 jours) est sans danger pour les personnes ayant eu un infarctus du myocarde. .
Diminution de la fiabilité Les méthodes de randomisation utilisées dans les ECR sont le plus souvent classées dans l'ordre suivant :
randomisation centralisée par téléphone par un statisticien indépendant, ou un représentant d'une entreprise pharmaceutique.
la méthode des contenants identiques codés (numérotés) fournis par une entreprise pharmaceutique, alors que le code et le contenu des contenants sont inconnus du patient ou des médecins participant à l'étude ;
méthode informatique centralisée - un programme informatique génère une séquence aléatoire de répartition des patients en groupes, similaire à la séquence d'un tableau de nombres aléatoires, dans le même temps, la division des patients en groupes de comparaison est effectuée par un spécialiste qui participe uniquement au processus de randomisation.
méthode des enveloppes opaques, scellées et numérotées. Les instructions d'intervention sont placées dans des enveloppes numérotées séquentiellement selon une table de nombres aléatoires. Il est extrêmement important que les enveloppes ne soient ouvertes qu'après que le chercheur ait écrit le nom du patient et d'autres données nécessaires à leur sujet dans le service d'admission;
Quelle que soit la méthode, la randomisation peut être simple et stratifié (il existe d'autres types de randomisation moins couramment utilisés). Dans le cas d'une randomisation simple, les facteurs supplémentaires ne sont pas pris en compte, et chaque patient a 50/50 chances d'entrer dans l'un ou l'autre groupe. La randomisation stratifiée (sélection de sous-groupes - strates) est utilisée dans les cas où il est impossible de créer des groupes avec le même pronostic de l'issue de l'expérience chez les sujets. Par exemple, si l'un des paramètres spécifiés (âge, niveau de pression artérielle, infarctus du myocarde, etc.) peut affecter le résultat de l'étude, les patients sont d'abord divisés en sous-groupes. Ensuite, dans chaque sous-groupe, le groupe est randomisé. Certains experts considèrent que la randomisation stratifiée est insuffisamment correcte.
Malgré l'extrême importance des informations sur la méthode de randomisation pour l'appréciation par le lecteur de la fiabilité des résultats de l'étude, différents auteurs donnent quasiment les mêmes estimations d'études sur ce paramètre. Il a été constaté que dans les années 80 à 90, seuls 25 à 35 % des rapports sur les ECR publiés dans des revues spécialisées et 40 à 50 % des rapports publiés dans des revues de médecine générale faisaient état de l'utilisation de la bonne méthode pour générer une séquence aléatoire d'inclusion. de participants en groupes. ... Dans presque tous ces cas, un générateur informatique ou une table de nombres aléatoires a été utilisé. Dans une analyse de 22 ans d'articles publiés dans une revue de dermatologie sur 22 ans, seulement 1 des 68 rapports d'ECR ont indiqué avoir utilisé la bonne méthode de séquençage aléatoire.
L'élément le plus important de l'organisation des ECR des moyens de traitement est l'utilisation de la méthode de l'insu (masquage). Comme indiqué dans la section précédente, les tests en double et même en triple aveugle sont préférés car les patients ou le personnel médical participant à l'essai, involontairement ou délibérément, peuvent fausser les données et ainsi affecter les résultats de la recherche.
Il est important de masquer les interventions des patients, car le résultat de l'exposition appliquée dépend en grande partie de l'état psychologique du patient. Avec l'ouverture de l'information, les patients du groupe expérimental peuvent soit espérer de manière injustifiée une issue favorable du traitement, soit, au contraire, s'inquiéter du fait qu'ils ont accepté d'être des « lapins expérimentaux ». Les patients du groupe témoin peuvent également se comporter différemment, par exemple, se sentir privés, surtout s'ils pensent que le processus de traitement est plus efficace dans le groupe expérimenté. Un état psychologique différent des patients peut conduire à une recherche délibérée de signes d'amélioration ou, au contraire, à une détérioration de leur état de santé, ce qui affectera inévitablement leur propre appréciation de l'état, dont les modifications s'avèrent souvent imaginaires. . Le déguisement du chercheur médical est nécessaire, car il peut être délibérément convaincu des avantages du médicament testé et interpréter subjectivement les changements dans l'état de santé des sujets.
La nécessité du double masquage confirme objectivement « l'effet placebo ». Placebo - Une forme posologique indiscernable du médicament à l'étude en termes d'apparence, de couleur, de goût et d'odeur, mais n'ayant pas d'effet spécifique, ou toute autre intervention indifférente utilisée dans la recherche médicale pour simuler un traitement afin d'éliminer le biais associé à l'effet placebo. L'effet placebo est une modification de l'état du patient (notée par le patient lui-même ou le médecin traitant) associée uniquement au fait du traitement, et non à l'effet biologique du médicament.
De nombreuses études ont montré que certains patients (selon la maladie jusqu'à 1/3), prenant un placebo pour un médicament, y réagissent de la même manière, ou presque de la même manière que les patients du groupe expérimental. L'étude de l'effet placebo permet d'isoler spécifique composants du nouveau traitement. De plus, si les patients ne savent pas à quel groupe ils appartiennent, ils suivent de plus près les règles de l'expérience.
Comme mentionné dans la section précédente, pour améliorer la fiabilité des conclusions, introduire troisième aveugle au stade du traitement des données statistiques, en confiant ces actions à des personnes indépendantes.
Les essais cliniques "à l'aveugle" ne sont pas utilisés lors de l'évaluation de l'efficacité potentielle des interventions chirurgicales, des méthodes de physiothérapie, des régimes alimentaires, de nombreuses procédures de diagnostic, etc. dans les cas où il est impossible de masquer l'impact, ou il est inapproprié pour les patients ou pour les médecins. Dans de tels cas, les essais randomisés sont appelés ouvert.
Une fois le temps d'observation spécifié écoulé, un traitement statistique des résultats identifiés (effets de l'exposition) de la maladie dans les groupes expérimentaux et témoins est effectué. Afin d'éviter les biais, les critères d'évolution de la maladie dans les groupes de patients expérimentaux et témoins doivent être spécifiques et identiques. Pour augmenter la fiabilité des conclusions, l'étude est souvent réalisée non pas simultanément, mais pendant une certaine période, y compris les patients nouvellement admis.
Pour le traitement statistique des données obtenues, le même tableau « deux par deux » est utilisé.

Tableau 11. Disposition du tableau « deux par deux » pour évaluer les résultats des études expérimentales.
La plupart des indicateurs évaluant l'efficacité de l'exposition expérimentale dans les essais cliniques et sur le terrain, bien qu'ils portent des noms différents (comme cela s'est produit historiquement), correspondent à la fois dans la méthode de calcul et dans la signification aux valeurs calculées dans les études de cohorte.
Divers indicateurs statistiques sont utilisés pour quantifier l'efficacité, alors qu'il n'y a pas d'unification stricte de leurs noms.
1.
L'indicateur d'efficacité relative (
indicateur de performance
):

Cette valeur correspond au risque relatif calculé dans les études de cohorte. ... L'indicateur de performance détermine combien de fois , la fréquence des résultats positifs de l'exposition dans le groupe expérimental est plus élevée que leur fréquence dans le groupe témoin, c'est-à-dire combien de fois une nouvelle méthode de traitement, de diagnostic, etc., meilleure que celle couramment utilisée.
Des critères d'évaluation sont utilisés pour interpréter l'indicateur de performance. risque relatif (voir traitement statistique des données des études de cohorte). Dans ce cas, en conséquence, le sens des formulations change, puisque ce n'est pas le facteur de risque de la maladie qui est évalué, mais l'efficacité de l'influence expérimentale appliquée.
2. Effet attributif (supplémentaire) , correspond au risque attributif (supplémentaire) déterminé dans les études de cohorte.

L'ampleur de l'effet attributif montre combien l'effet de l'exposition expérimentale est supérieur à l'effet de l'exposition dans le groupe témoin ;
3 . La proportion de l'impact (proportion de l'efficacité) correspond à la proportion étiologique calculée dans l'analyse des données des études de cohorte.

Cette valeur montre la proportion de résultats positifs appartenant à l'effet expérimental dans la somme des effets positifs dans le groupe expérimental.
4. une quantité supplémentaire appelée - nombre de patients à traiter (NNT) pour éviter un effet indésirable.

Plus cet indicateur est élevé, plus l'efficacité potentielle de l'impact étudié est faible.
Comme pour le traitement des données des études de cohorte, la fiabilité des données obtenues expérimentalement est évaluée à l'aide du test du chi carré ou d'autres méthodes.
En conclusion, nous notons que, malgré tous les avantages, les essais cliniques randomisés sont chargés de la possibilité de biais, en particulier des biais d'échantillonnage. Par conséquent, les résultats d'une étude, même sans faille dans l'organisation, ne peuvent être considérés comme une recommandation inconditionnelle pour l'utilisation d'un nouveau médicament en pratique clinique. C'est pourquoi, à l'heure actuelle, seuls les résultats sont considérés comme fiables. études multicentriques l'efficacité d'une même intervention (traitement) par plusieurs cliniques, alors qu'il est souhaitable que les études soient menées dans des cliniques de pays différents.

