Saskaņā ar MIT pētniekiem, kas testē jaunu eksperimentālu pretvēža līdzekli fenantriplatīns, šīs zāles ir izrādījušās efektīvākas par pašlaik plaši lietotajām cisplatīns. Profesors Stīvens J. Lippards un kolēģi norāda, ka fenantriplatīns ne tikai labāk nogalina vēža šūnas, bet arī var novērst platīna zāļu rezistences attīstību.
Ķīmijterapija ar platīna preparātiem ir viena no spēcīgākajām vēža apkarošanas metodēm. Cisplatīns pirmo reizi tika pārbaudīts 1978. gadā ASV. Tas ir efektīvs galvenokārt pret sēklinieku vēzi, bet tiek izmantots arī limfomas, plaušu vēža, olnīcu vēža un vairāku citu vēža veidu ārstēšanā. Tomēr šai monētai ir arī otrā puse: izteikti toksiska nevēlamas reakcijas un audzēja šūnu rezistences veidošanos pret zālēm.
...balstoties uz jaunākā pētījuma rezultātiem, zinātnieks paziņoja par iespēju izmantot platīna ķīmijterapiju plašākam vēža slimību lokam.
Lippards jau ilgu laiku ir pētījis platīna zāles. Kā viņš pats presei atzinis, viņa sākotnējais pieņēmums par šo medikamentu šauro specifiku bijis kļūdains. Tagad, pamatojoties uz jaunākā pētījuma rezultātiem, zinātnieks paziņoja par iespēju izmantot ķīmijterapiju ar platīna preparātiem plašākam vēža slimību lokam.
Galvenās fenantriplatīna priekšrocības salīdzinājumā ar cisplatīnu ir:
- vieglāk iekļūst vēža šūnās;
- kavē transkripciju (pirmais solis ceļā uz ieviešanu ģenētiskā informācijašūnas, pārvēršot DNS par RNS).
Platīna zāļu citostatiskā iedarbība balstās uz ķēdes iekšienē esošo garenvirziena un šķērssaišu veidošanos DNS, kas novērš tās replikāciju. Tas ir saistīts ar pašu datu ķīmisko struktūru zāles: centrā ir platīna atoms, kas saistīts ar diviem amonija ligandiem un diviem hlorīda joniem. Visam šim kompleksam ir negatīvs lādiņš, bet, iekļūstot vēža šūnā, tas tiek hidrolizēts, aizstājot hlorīda jonus ar OH grupām un iegūstot pozitīvu lādiņu. OH grupas var viegli pārvietot, ļaujot platīna kompleksam uzbrukt vēža šūnu DNS.
Iepriekš tika uzskatīts, ka citostatisko efektu var realizēt, tikai mijiedarbojoties ar diviem DNS saistīšanas centriem, jo tas ļāva veidot krusteniskās saites starp DNS sekcijām. Bet 80. gados zinātnieki sāka pētīt pozitīvi lādētus platīna kompleksus, kas saistījās ar vienu DNS centru, bet kuriem bija arī citostatiska iedarbība.
2008. gadā pētīja Lipparda vadītā zinātnieku grupa piriplatīns. Šīs zāles ir gandrīz identiskas cisplatīnam ar vienu izņēmumu: viens no hlora joniem ir aizstāts ar sešu locekļu piridīna gredzenu, kas satur piecus oglekļa atomus un vienu slāpekļa atomu. Tomēr tā efektivitāte bija zemāka nekā cisplatīna un oksaliplatīns, vēl viens FDA apstiprināts pretvēža līdzeklis. Taču pirmā neveiksme pētniekus nesatrauca. Eksperimenti ar piriplatīnu lika viņiem domāt par platīna savienojumu ar lieliem gredzeniem izmantošanas lietderīgumu onkoloģijā. Pēc viņu domām, šī ķīmiskās struktūras iezīme ļaus lielākā mērā bloķēt audzēja šūnu DNS transkripciju. Tātad, izmantojot izmēģinājumus un kļūdas, viņi nonāca pie fenantriplatīna. Zinātnieki saprata, ka tas ir tieši tas, ko viņi meklēja, kad fenantriplatīns, salīdzinot to efektivitāti, sašķaidīja cisplatīnu. Pētījumā tika izmantoti 60 vēža šūnu veidi, un fenantriplatīns atkarībā no šūnu veida bija 4 līdz 40 reizes labāks nekā cisplatīns. Tādējādi jaunās zāles var lietot gadījumos, kad cisplatīns ir bezspēcīgs.
Cits svarīgs punkts. Dažas audzēja šūnas spēj attīstīt rezistenci pret cisplatīna iedarbību. Šīs šūnas satur sēru saturošu komponentu – glutationu, kas inaktivē cisplatīnu, pirms tas saistās ar DNS. Apjomīgais trīs locekļu gredzens, kas iekļauts fenantriplatīna struktūrā, precīzi aizsargā platīna kompleksu no trešo pušu uzbrukumiem.
Tagad, kad zāles ir apstiprinājušas savu efektivitāti laboratorijas eksperimentos, zinātnieki saskaras ar uzdevumu pārbaudīt tā pretvēža iedarbību uz dzīvniekiem.
Catad_tema Sieviešu reproduktīvās sistēmas audzēji - raksti
Paklitaksela ķīmijterapija plus platīna pret parasto platīna ķīmijterapiju sievietēm ar recidivējošu olnīcu vēzi: ICON4/AGO-OVAR-2.2 pētījums
ICON un AGO izmēģinājuma dalībnieki*
KOPSAVILKUMS
Fons.
Neskatoties uz progresu olnīcu vēža ārstēšanā, lielākajai daļai pacientu slimība atkārtojas trīs gadu laikā pēc diagnozes noteikšanas. Pašlaik nav vienprātības par otrās līnijas ārstēšanu recidīva gadījumā. Mēs novērtējām paklitaksela un platīna kombināciju kā šīs ārstēšanas shēmu.
Metodes.
Paralēli starptautiski daudzcentru randomizēti pētījumi no 1996. gada janvāra līdz 2002. gada martam. No 119 slimnīcām piecās valstīs pētījumā tika iekļauti 802 pacienti ar recidivējošu pret platīnu jutīgu olnīcu vēzi. Pacienti recidivēja pēc sešu mēnešu perioda, kura laikā viņi netika ārstēti. Šie pacienti tika randomizēti vai nu paklitaksela/platīna ķīmijterapijai, vai parastajai platīna ķīmijterapijai. Analīze, izņemot toksisko ietekmi, tika veikta attiecībā uz visiem pacientiem, kuri sākotnēji bija paredzēti ārstēšanai.
rezultātus.
Vidēji 42 mēnešu novērošanas laikā nomira 530 pacienti. Izdzīvošanas līknes deva priekšroku paklitaksela/platīna lietošanai (riska attiecība 0,82, p=0,02), radot absolūtu dzīvildzes atšķirību pēc diviem gadiem 7% apmērā starp paklitaksela/platīna grupu un parastās aprūpes grupu (57 pret 50 %), kā arī atšķirību vidējā dzīvildze 5 mēneši (29 un 24 mēneši). 717 pacienti piedzīvoja slimības progresēšanu vai nomira. Dzīvildzes bez slimības progresēšanas līknes uzrādīja atšķirību par labu paklitakselam/platīnam (riska attiecība 0,76, p=0,0004), kas atbilst absolūtai atšķirībai viena gada dzīvildzei bez slimības progresēšanas 10% (50% pret 40%) un atšķirībai vidējā dzīvildze bez slimības progresēšanas ir 3 mēneši (13 un 10 mēneši).
Interpretācija.
Paklitaksela/platīna kombinācija nodrošina labāku kopējo dzīvildzi un dzīvildzi bez slimības progresēšanas, salīdzinot ar parasto platīna ķīmijterapiju pacientiem ar recidivējošu pret platīnu jutīgu olnīcu vēzi.
Ievads
Olnīcu vēzis ir ceturtais visizplatītākais sieviešu vēzis, kas izraisīja aptuveni 114 000 nāves gadījumu visā pasaulē 2000. gadā.1 Šīs slimības ārstēšana pēdējos trīsdesmit gados ir uzlabojusies, pateicoties progresam ķirurģijā un uz zālēm balstītās platīna ķīmijterapijas jomā, bet lielākā daļa sieviešu ar olnīcu vēža recidīvu. un mirst piecu gadu laikā.
Nav vienprātības par optimālo otrās līnijas ārstēšanu recidivējošai slimībai, neskatoties uz vairākām pieejamajām zālēm. Pirmās līnijas ārstēšana ir uz platīnu balstīta ķīmijterapija, arvien vairāk tiek lietots karboplatīns (ar vai bez taksāna), nevis cisplatīns, jo karboplatīnam ir mazāka toksicitāte ar līdzīgu aktivitāti. Uz platīnu balstīta ķīmijterapija ir atkarīga no platīna brīvā perioda ilguma. Kad periods pārsniedz sešus mēnešus, daudzi klīnicisti izvēlas atkārtoti ārstēt pacientus ar platīnu, izmantojot iepriekš lietotās zāles vai nomainot pacientu no karboplatīna uz cisplatīnu vai otrādi. Sievietes, kuru slimība ir progresējusi sākotnējās platīna terapijas laikā, un sievietes, kurām atkārtojas sešu mēnešu laikā pēc sākotnējās ārstēšanas ar platīnu, reti reaģē uz turpmāku platīna terapiju, un tiek uzskatīts, ka tām ir pret platīnu rezistenta slimība. Paklitaksels pirmo reizi tika ierosināts kā aktīvas zāles šiem pacientiem.5 Šīs zāles parasti ir labi panesamas, un visbiežāk sastopamās blakusparādības ir alopēcija, mielosupresija un neiropātijas.
Lielākajai daļai pacientu nav pret platīnu rezistentu slimību, bet tie atkārtojas sešu mēnešu vai vairāk mēnešu laikā pēc pirmās izvēles ārstēšanas.6 Nav skaidrs, vai tādas zāles kā paklitaksels, kam ir atšķirīgs darbības mehānisms nekā platīna zālēm, būtu labvēlīgas šiem pacientiem. (ja lieto kombinācijā ar platīnu), nevis atkārto parasto uz platīnu balstītu ķīmijterapijas shēmu. Pētījumos ar pacientiem ar recidivējošu pret platīnu jutīgu slimību, tika ziņots par līdz pat 90% atbildes reakcijas līmeni, lietojot karboplatīnu/paklitakselu.7,8 Tomēr mēs neesam informēti par iepriekšējiem randomizētiem pētījumiem, kuros paklitaksels/platīns būtu salīdzināts ar parasto uz platīnu balstītu ķīmijterapiju pacientiem ar olnīcu vēzi, kam recidīvs sešus mēnešus vai ilgāk pēc ķīmijterapijas. Randomizētajos pētījumos ICON4 un AGO-OVAR-2.2 mēs apšaubījām paklitaksela/platīna efektivitāti pacientiem ar iepriekš ārstētu olnīcu vēzi. Mūsu mērķis bija noteikt, vai paklitaksels ir jāpievieno shēmai, kuras pamatā ir platīns, lai ārstētu pacientus ar pret platīnu jutīgu slimību, kuri citādi tiktu ārstēti ar tradicionālajām platīna bāzes shēmām.
Pacienti un metodes
ICON4 un AGO-OVAR-2.2 testi tika veikti kā paralēli testi.
ICON4 izmēģinājumu koordinēja Mario Negri institūts (Milāna, Itālija) (IRFMN) un Medicīnas pētījumu padomes klīnisko pētījumu nodaļa (Londona, Apvienotā Karaliste) (MRC CTU). AGO-OVAR-2.2 izmēģinājumu koordinēja AGO (Karlsrūe, Vācija).
Slims
Pacienti pētījumā tika iesaistīti no 1996. gada janvāra līdz 2002. gada martam no 119 slimnīcām piecās valstīs. Pacienti tika iedalīti vienā no trim protokoliem; vienu koordinēja MRC CTU slimnīcām Apvienotajā Karalistē, Norvēģijā un Šveicē; vienu koordinēja IRFMN Itālijai, bet vienu veica AGO aizbildnībā. Kritēriji pacientu iekļaušanai pētījumā bija šādi: recidivējoša epitēlija olnīcu vēzis, kam nepieciešama ķīmijterapija; iepriekšēja ķīmijterapija, izmantojot platīna zāles; bez ārstēšanas ilgāk par 6 mēnešiem (>12 mēneši ICON4 grupai Itālijā); vienlaicīgas vai iepriekšējās neesamība ļaundabīga slimība kas var ietekmēt ārstēšanu vai tās rezultātus; pacienta rakstiska piekrišana dalībai izmeklēšanā, kas iegūta pēc informēšanas.
Kritēriji, kas pacientiem bija jāatbilst, lai piedalītos izmēģinājumā, trijos protokolos nedaudz atšķīrās. Saskaņā ar MRC CTU protokolu pacientiem varēja būt vairāk nekā viena iepriekšēja ķīmijterapijas līnija, savukārt pacientiem, kas randomizēti saskaņā ar Itālijas AGO protokolu, bija atļauts saņemt tikai vienu iepriekšēju ķīmijterapijas līniju. Pacientiem, kas randomizēti saskaņā ar Itālijas protokoliem, bija nepieciešama izmērāma audzēja klātbūtne; šī prasība nebija MRC CTU vai AGO protokoliem. Slimības recidīva diagnoze, uzsākot izmēģinājumu, 18 pacientiem MRC CTU protokolā tika balstīta uz paaugstinātu CA125 līmeni. Pacientiem, kas randomizēti AGO protokolā, iepriekš jābūt ārstētiem ar cisplatīnu/paklitakselu vai karboplatīnu/paklitakselu; ICON4 pētījumā pacientiem bija iepriekš jāsaņem platīna ķīmijterapija ar vai bez paklitaksela.
Metodes
Pacienti tika randomizēti vai nu parastajai platīna ķīmijterapijai, vai līdzīgai platīna un paklitaksela devai, ārstēšanu uzsākot pēc iespējas ātrāk. īss laiks pēc randomizācijas. Saskaņā ar visiem protokoliem ārstēšanas kursi tika veikti ik pēc trim nedēļām. Saskaņā ar MRC CTU protokolu katram pacientam bija jāiziet vismaz seši kursi. Saskaņā ar Itālijas protokolu pacientiem tika nozīmēti vismaz trīs kursi, un turpmākie trīs kursi tika noteikti atkarībā no atbildes reakcijas uz ārstēšanu. Saskaņā ar AGO protokolu pacientiem tika nozīmēti vismaz seši un ne vairāk kā astoņi ārstēšanas kursi, un atbildes reakcija uz ārstēšanu tika novērtēta pēc otrā un ceturtā kursa. Visas zāles tika ievadītas intravenozi katra kursa pirmajā dienā. Karboplatīna deva tika noteikta, izmantojot laukumu zem līknes (AUC) metodi, ko aprakstīja Calvert et al.9, un tā bija vismaz 5 (GFR+25) mg, kur GFR ir GFR, kas noteikts ar radioizotopu vai 24 stundu urīna savākšanu. Ja glomerulārās filtrācijas ātrums tika noteikts, izmantojot Kokkrofta formulu, karboplatīna deva bija vismaz 6 (GFR+25) mg. Plānotā minimālā cisplatīna deva ICON4 pētījuma pacientiem atsevišķi bija 75 mg/m2, kad cisplatīnu lietoja kā vienu līdzekli, un 50 mg/m2, ja to lietoja kombinācijā ar citām zālēm. ICON4 pētījumā pacientiem, kuriem tika nozīmēta ārstēšana ar paklitaksela/platīna kombināciju, bija jāsaņem paklitaksela 175 mg/m2 3 stundu ilgas infūzijas veidā, kam sekoja karboplatīna vai cisplatīna infūzija iepriekš minētajā devā. Pacientiem AGO protokolā, kas tika piešķirts paklitaksela/karboplatīna terapijas grupai, bija jāsaņem paklitaksela 185 mg/m2 3 stundu ilgas infūzijas veidā, kam sekoja karboplatīna infūzija iepriekš norādītajā devā.
Randomizācija trim protokoliem tika veikta neatkarīgi. Par visiem pacientiem tika apkopota viena un tā pati informācija. Randomizācijas attiecība starp ārstēšanas grupām bija 1:1. Randomizācija, ko veica pa tālruni vai faksu, izmantoja datorizētu minimizēšanas metodi. Divos ICON4 izmēģinājuma protokolos (MRC CTU un itāļu valodā) stratifikācija tika veikta, pamatojoties uz tiem pašiem faktoriem, proti, vietu, pacienta vecumu, pēdējo ievadīto ķīmijterapiju, laiku kopš pēdējās ķīmijterapijas pabeigšanas un plānoto platīna terapiju. Plānotais platīna režīms bija jānosaka pirms randomizācijas. AGO protokolā tika veikta stratifikācija attiecībā uz laiku kopš pēdējās ķīmijterapijas pabeigšanas, kā arī par to, vai pacientam tika vai nav veikta otrā citoredukcijas operācija (audzēja masas samazināšana.
ICON4 izmēģinājumam tika izveidota neatkarīga datu uzraudzības un ētikas komiteja, kurā bija divi klīnicisti un viens statistiķis, kas nav saistīts ar izmēģinājumu. Izmēģinājuma norise un tā atklātie rezultāti, kā arī visi citi svarīgie ārējie dati tika pārskatīti aptuveni reizi gadā pacientu uzņemšanas laikā pētījumā. Komiteja neievēroja iepriekš noteiktus statistikas noteikumus apturēšanai. AGO izmēģinājumam datu uzraudzības un ētikas komiteja netika izveidota, bet protokolu pārskatīja un pieņēma katra iesaistītā centra vietējās ētikas komitejas.
Dati, kas attiecas uz pirmsapstrādes periodu, tika savākti randomizācijas laikā.
Ārstēšanas dati tika apkopoti par katru kursu. Pēcpārbaudes apsekojuma dati tika vākti ik pēc trim mēnešiem pirmajos divos gados un ik pēc sešiem mēnešiem pēc tam. Lai apkopotu datus no šīm aptaujām, pēc pēdējā ziņojuma mēs izmantojām vienas lapas veidlapu, kurā bija iekļauti jautājumi par slimību, dzīvības stāvokli, simptomiem, blakusparādībām un ārstēšanu. Visus šos datus apkopoja, pārbaudīja un elektroniski uzglabāja izmēģinājumā iesaistītās komandas.
Dzīves kvalitātes dati tika apkopoti par visiem pacientiem, kuri tika ārstēti saskaņā ar MRC CTU un AGO protokolu. Mēs izmantojām Eiropas vēža pētniecības un ārstēšanas organizācijas (EORTC) izstrādāto dzīves kvalitātes aptauju QLQ-C30 (versija 2.0). Pacienti, kuri tika ārstēti saskaņā ar MRC CTU protokolu, aizpildīja anketu sākumā, pirms katra protokola ārstēšanas kursa un 6, 9 un 12 mēnešu apmeklējumos. Pacienti, kuri tika ārstēti ar AGO protokolu, aizpildīja anketu sākumā, pirms otrā un trešā protokola ārstēšanas kursa, protokola ārstēšanas beigās un ik pēc trim mēnešiem gadu pēc protokola ārstēšanas pabeigšanas.
Mēs veicām vairākas apakšgrupu analīzes. Apakšgrupas kritēriji ietvēra randomizācijas grupu, laiku kopš pēdējās ķīmijterapijas pabeigšanas, iepriekšējo ķīmijterapijas līniju skaitu, iepriekšējo taksānu terapiju, ārstēšanai paredzēto platīna līdzekli, vecumu un darbības statusu.
Statistiskā analīze
Galvenais mērķa kritērijs bija kopējā dzīvildze; Sekundārie rezultāti bija dzīvildze bez slimības progresēšanas un dzīves kvalitāte. Kad tika aprēķināti sākotnējie paraugu lielumi, bija pieejami maz datu par atkārtota olnīcu vēža iznākumu. Mēs sagaidām, ka 2 gadu dzīvildze kontroles grupā būs aptuveni 5%, un absolūtās atšķirības 2 gadu dzīvildze būs ne vairāk kā 5–10%.
Mēs plānojām kopā 800 pacientus izmēģinājumam, lai pārliecinoši noteiktu absolūtu dzīvildzes atšķirību divu gadu laikā 5% (5-10%) ar 95% ticamību 5% ticamības līmenī; tas atbilst riska koeficientam 0,77. Pēdējā sanāksmē 2001. gada 8. februārī Datu uzraudzības un ētikas komiteja atzīmēja, ka izdzīvošana kontroles grupā bija ievērojami augstāka nekā sākotnējie ticamības aprēķini. Divu gadu dzīvildze parastajā aprūpes grupā bija 50%. Līdz ar to mēs esam pārskatījuši šo jautājumu. Mēs aprēķinājām, ka ar 800 pacientiem pietiktu, lai ticami noteiktu absolūto 11% atšķirību dzīvildzei pēc diviem gadiem (50–61%) ar 90% jaudu 5% ticamības līmenī, iegūstot riska attiecību 0, 71. Tāpēc izmēģinājumam plānotais pacientu skaits palika nemainīgs.
Mēs salīdzinājām Kaplan-Meier līknes attiecībā uz kopējo dzīvildzi un dzīvildzi bez progresēšanas ar Mantel-Cox log-rank testa versiju, stratificējot trīs randomizācijas grupās. Kopējā dzīvildze tika definēta kā laiks no randomizācijas līdz nāvei jebkura iemesla dēļ; pacienti, par kuriem bija zināms, ka analīzes laikā bija dzīvi, tika skaitīti pēdējās pārbaudes laikā. Mēs definējām dzīvildzes laiku bez slimības progresēšanas kā laiku no randomizācijas līdz pirmajam slimības progresēšanas vai nāves gadījumam jebkura iemesla dēļ; Pacienti, kuri bija dzīvi un kuriem analīzes laikā nebija slimības progresēšanas pazīmju, tika ņemti vērā pēdējās pārbaudes laikā. Pats par sevi CA125 koncentrācijas pieaugums, t.i.
netika uzskatīts, ka progresējošas slimības klīnisko vai radioloģisko pazīmju neesamības palielināšanās liecina par slimības progresēšanu. Absolūtais ieguvums noteiktā laika brīdī tika aprēķināts no Kaplana-Meijera dzīvildzes, kas tika novērtēta kontroles grupā šajā laika posmā (kontroles dzīvildze) un riska attiecības, izmantojot šādu izteiksmi: absolūtais ieguvums = exp(riska koeficients x log[kontroles izdzīvošana ]) - izdzīvošana kontrolē.
Tāda pati pieeja tika pieņemta izdzīvošanai bez progresēšanas. Lai gan šī pieeja netieši paredz proporcionālu apdraudējumu esamību, labāk ir ņemt vērā atšķirības starp Kaplan-Meier līknēm atsevišķos laika punktos. Līdzīgi aprēķinājām atšķirības attiecībā pret mediānām, taču, izmantojot izteiksmi: mediānu atšķirība = (kontroles/riska attiecības mediāna) – kontroles mediāna. Šī pieeja paredz, ka izdzīvošanas laikiem ir aptuveni eksponenciāls sadalījums.
Mēs novērtējām platīna-medikamentu ķīmijterapijas relatīvo izdzīvošanas ieguvumu uz izmēģinājumu balstītā pētījumā apakšgrupās, kas definētas pēc randomizācijas grupas, laiks kopš pēdējās ķīmijterapijas pabeigšanas, iepriekšējo ķīmijterapijas līniju skaits, iepriekšēja taksānu lietošana, ārstēšanai plānotais platīna līdzeklis, t.i. karboplatīns vai cisplatīns, vecums un funkcionālais stāvoklis. Lai novērtētu atšķirības relatīvo efektu lielumos apakšgrupās, mēs izmantojām χ2 testu mijiedarbībai vai, ja iespējams, χ2 testu tendencei.
Lai analizētu datus par dzīves kvalitāti, kā ieteikts, mēs izmantojām piecas funkcionālās skalas (fiziskās, lomu, emocionālās, kognitīvās un sociālās), deviņas simptomu skalas (nogurums, slikta dūša un vemšana, sāpes, elpas trūkums, bezmiegs, apetītes zudums, aizcietējums, caureja un finansiālas grūtības), un vispārējais statuss veselība. Ņemot vērā olnīcu vēža raksturu, mūs īpaši interesēja nogurums, slikta dūša/vemšana un sāpju simptomi, kā arī vispārējais veselības stāvoklis kā vispārējs pasākums. Katram kritērijam mēs analizējām divas kopsavilkuma statistikas kopas: sliktākais rezultāts un laukums zem līknes pirmajos sešos mēnešos.11 Analīzei tika izmantots neparametriskais Manna-Vitnija tests.12 Mēs izvēlējāmies p = 0,005 kā nozīmīguma vērtību ( vairāku salīdzinājumu dēļ).
Analīzes tika veiktas visiem pētījumā iekļautajiem pacientiem (angļu valodas literatūrā - "nodoms ārstēt" kritērijs), izņemot toksiskās ietekmes analīzi. Analīzes par toksisko iedarbību attiecās tikai uz pacientiem, kuri saņēma vismaz vienu paredzēto ārstēšanas kursu. Visas p vērtības ir divpusējas. Analīze tika veikta, izmantojot SAS pakotni (versija 8.20).
Finansējuma avota loma
Izmēģinājuma sponsoriem nebija nekādas lomas izmēģinājuma plānošanā, datu vākšanā, datu analīzē, datu interpretācijā vai ziņojuma rakstīšanā.
rezultātus
Izmēģinājumā piedalījās 802 pacienti. Pacientu uzņemšanas perioda ilgums izmēģinājumā bija atšķirīgs trim protokoliem: Itālijas grupai ICON4 - no 1996. gada janvāra līdz 2002. gada martam; MRC CTU ICON4 grupai - no 1996. gada maija līdz 2002. gada martam un AGO - no 1996. gada oktobra līdz 1999. gada septembrim. Četri simti desmit pacienti tika iekļauti tradicionālās platīna ķīmijterapijas grupā un 392 pacienti paklitaksela/platīna grupā (1. attēls).
Pirmsapstrādes raksturlielumi abām grupām bija līdzīgi (1. tabula).
Saņemtie ārstēšanas veidi ir uzskaitīti 2. tabulā. 580 pacienti (72%) abās ārstēšanas grupās saņēma vismaz sešus ķīmijterapijas ciklus (1. att.). Sešu ārstēšanas kursu nepabeigšanas iemesli bija šādi: slimības progresēšana vai nāve (109), toksiska ietekme ārstēšanas laikā 77) un pacienta vēlme (9). Tikai trīs pacienti nesaņēma izrakstīto ķīmijterapiju (1. att.). 123 (41%) no 300 pacientiem parastajā aprūpes grupā un 129 (40%) no 322 pacientiem, kuri tika ārstēti ar paklitakselu un karboplatīnu, saņēma vairāk nekā 90% no plānotās kopējās devas, un 54 (18%) no 300 pacientiem un 76 ( 23%) no 330 pacientiem attiecīgi saņēma vairāk nekā 90% no kopējās karboplatīna devas. Attiecīgie paklitaksela rādītāji paklitaksela/karboplatīna grupā bija 266 (71%) no 376 pacientiem kopējās devas gadījumā un 160 (43%) no 376 kopējās devas intensitātes gadījumā.
3. tabulā parādīts to pacientu īpatsvars, kuriem ārstēšanas laikā radās vidēji smagas vai smagas blakusparādības. Kā jau varēja gaidīt, paklitaksela/platīna kombinācija izraisīja lielāku alopēcijas procentuālo daļu, salīdzinot ar parasto platīna ķīmijterapiju. Vidēji smagas vai smagas hematopoētiskās toksicitātes procentuālais daudzums bija lielāks pacientiem, kuri tika ārstēti ar parasto platīna ķīmijterapiju, salīdzinot ar paklitaksela/platīna kombinācijas grupu. Vidēji vai smagi neiroloģiski toksiski efekti tika novēroti 76 (20%) pacientiem, kuri saņēma paklitaksela/platīna kombināciju. Citi toksiski efekti abās ārstēšanas grupās bija reti.
Līdz 2003. gada martam (vidējais novērošanas laiks 42 mēneši) bija miruši 530 pacienti (66 %). Izdzīvošanas līknes atbilst riska attiecībai 0,82 (95% TI 0,69–0,97, p=0,02; 2. att.), kas atbilst absolūtai divu gadu dzīvildzes atšķirībai 7% par labu paklitaksela/zāļu kombinācijas ķīmijterapijai. ar parasto ārstēšanu (57 un 50%). Vidējai dzīvildzei riska attiecība atbilst 5 mēnešu (29 un 24 mēnešu) starpībai. 717 pacientiem (89%) attīstījās progresējoša slimība vai viņi nomira. Izdzīvošanas līknes bez progresēšanas ir parādītas attēlā. 3. Riska attiecība 0,76 (0,66-0,89, p=0004) par labu paklitaksela/platīna shēmai atbilst aplēstajai absolūtajai atšķirībai viena gada dzīvildzes bez slimības progresēšanas 10% (40% pret 50%). Šis rezultāts atbilst absolūtai atšķirībai vidējā dzīvildze bez slimības progresēšanas 3 mēnešus par labu paklitaksela/platīna shēmai (9 un 12 mēneši).
69 (54%) no 128 pacientiem tradicionālās ķīmijterapijas grupā bija pilnīga vai daļēja atbildes reakcija uz ārstēšanu, salīdzinot ar 78 (66%) no 119 pacientiem paklitaksela/platīna grupā.
Attiecīgi atbildes reakcija uz ārstēšanu šķiet labāka paklitaksela/platīna grupā (atšķirība 12% [-0,1% līdz 24%], p=0,06). Mēs nenovērojām nekādas skaidras norādes, ka paklitaksels/platīns būtu efektīvāks vai mazāk iedarbīgāks par parasto platīna ķīmijterapiju nevienā no apakšgrupām attiecībā uz kopējo dzīvildzi vai dzīvildzi bez slimības progresēšanas (4. un 5. attēls).
Sīkāka informācija par ārstēšanu, kas tika veikta slimības progresēšanas laikā, bija pieejama 437 no 536 pacientiem. Kopumā 70 (31%) pacienti parastajā ārstēšanas grupā progresēšanas laikā saņēma taksānu terapiju. Paklitaksela/platīna kombinācijas grupā 16 (8%) pacienti pēc progresēšanas turpināja saņemt turpmāku ārstēšanu ar taksānu bāzes shēmu.
Grupā, kas izmantoja MRC CTU ICON4 protokolu, 482 (90%) no 536 pacientiem aizpildīja dzīves kvalitātes anketu sākumā pirms ārstēšanas. Visas skalas bija līdzsvarotas abās ārstēšanas grupās. Lielākajai daļai pacientu nebija funkcionālu grūtību vai tie bija nelieli; vidēji smagu vai smagu simptomu skaits sākotnēji bija neliels. Pirmajos sešos mēnešos pēc randomizācijas sliktākie rādītāji un apgabali zem līknēm neatšķīrās starp abām ārstēšanas grupām visās piecās funkcionālajās skalās, astoņās no deviņām simptomu skalām un globālā veselības stāvokļa. Vienīgais izņēmums bija slikta dūša un vemšana, kas bija smagāka pacientiem, kuri saņēma parasto ķīmijterapiju (p=0,0014 sliktākajam rādītājam, p=0,005 laukumam zem līknes). Attēlā 6. attēlā parādīti rādītāji laika gaitā attiecībā uz trim olnīcu vēža raksturīgākajiem simptomiem — nogurumu, sliktu dūšu un vemšanu —, kā arī sāpēm un vispārējo veselības stāvokli. Attiecībā uz globālo veselības stāvokli pirmo sešu mēnešu laikā bija nedaudz samazinājies to pacientu īpatsvars, kuriem bija slikts vai ļoti slikts veselības stāvoklis. Līdzīga tendence tika novērota noguruma sajūtai. Gluži pretēji, sāpju simptomi abās grupās atgriezās pie vērtībām, kas raksturīgas periodam pirms ārstēšanas.
Lai gan ir dažas norādes par sliktu dūšu un vemšanu par labu paklitaksela/platīna grupai, šādas atšķirības ir īslaicīgas, un tās skar tikai pirmās 15 nedēļas.
Diskusija
Ņemot vērā dzīvildzi bez slimības progresēšanas un kopējo dzīvildzi, pietiekami daudz pacientu mūsu pētījumā bija dzīvi un bija pakļauti riskam pēc 4 gadiem, lai secinātu, ka vispārīgie rezultāti ir uzticami šim periodam. Deviņdesmit procenti pacientu tika randomizēti pēc pirmā recidīva un 75% vairāk nekā 12 mēnešus pēc platīna ķīmijterapijas pabeigšanas. Tiek uzskatīts, ka šādiem pacientiem ir saprātīga prognoze. Fakts, ka mūsu izmēģinājums ir liels, ļāva mums analizēt apakšgrupas, lai novērtētu, cik konsekventa ir paklitaksela/platīna iedarbība. Tomēr daudzas apakšgrupas ir mazas, un tāpēc spēja noteikt reālas atšķirības ir zema. Tomēr nav labu pierādījumu, kas apstiprinātu lielāku vai mazāku paklitaksela/platīna iedarbību, salīdzinot ar tradicionālo ārstēšanu nevienā no apakšgrupām. Paklitaksela/platīna iedarbības apjoms randomizācijas grupās bija līdzīgs, neskatoties uz atšķirībām kritērijos, kas tika izmantoti, lai iekļautu pacientus pētījumā, un stratifikācijas faktoros. Turklāt nekas neliecina, ka paklitaksela/platīna kombinācijas iedarbība atšķirtos pacientiem, kuri saņēma taksānus kā daļu no pirmās izvēles terapijas (apmēram 40% no kopējā randomizēto pacientu skaita), un tiem pacientiem, kuri nesaņēma taksānus.
Paklitakselu vienu pašu salīdzināja ar ciklofosfamīdu, doksorubicīnu un cisplatīnu (CAP režīms) pacientiem, kuriem bija atbildes reakcija uz pirmās līnijas platīna ķīmijterapiju, bet kuriem slimība recidivēja pēc vairāk nekā 12 mēnešus ilgas ārstēšanas bez ārstēšanas.13 Ziņotajā pētījuma runā 97 pacienti ar Novērtējama slimība, paklitaksela monoterapija nodrošināja vidējo bezprogresēšanas laiku 9 mēnešus, salīdzinot ar 15,7 mēnešiem SAR shēmā (riska attiecība 0,69). Vidējā kopējā dzīvildze bija 25,8 mēneši paklitaksela monoterapijai un 34,7 mēneši CAP shēmai (0,58). Lai gan pacientu skaits nav pietiekami liels, lai izdarītu galīgus secinājumus, šie rezultāti liecina, ka uz platīnu balstīta ķīmijterapija ir svarīga ķīmijterapijas sastāvdaļa recidīva gadījumā, ja slimība joprojām ir jutīga pret platīnu.
Mūsu rezultāti liecina par platīna un paklitaksela aditīvu iedarbību.
Līdzīgi dati tika novēroti dažos pirmās izvēles pētījumos (ciklofosfamīds 750 mg/m2 plus cisplatīns 75 mg/m2 tika izmantots GOG-11114 pētījumā un OV1015 pētījumā), bet ne citos (cisplatīna 100 mg/m2 monoterapijā). m2 ; izmēģinājums GOG-13216 un karboplatīns ar minimālo AUC 5 vai ciklofosfamīda 500 mg/m2, doksorubicīna 20 mg/m2 un cisplatīna 50 mg/m2 kombinācija, ko izmantoja ICON izmēģinājumā36)17. ICON3 un GOG-132 testa rezultāti atšķiras no pozitīvs rezultāts novēroja mūsu pētījumā, kurā 85% pacientu paklitaksela/platīna grupā saņēma karboplatīna un paklitaksela kombināciju. Tomēr pētītās pacientu populācijas grupā ir diezgan atšķirīgas. Var uzskatīt, ka mūsu pētījumā iesaistītajām sievietēm ir pret platīnu jutīga slimība, un tām ir liela iespēja reaģēt uz turpmāku platīna terapiju, taču viņu slimība, visticamāk, būs mazāk jutīga pret platīnu nekā pacientiem, kuri vispār nesaņēma ķīmijterapiju. Šo teoriju apstiprina atbildes reakcijas rādītājs 54% apmērā uz parasto ķīmijterapiju mūsu apstākļos, kas ir nedaudz zemāks nekā gaidīts pirmās izvēles ārstēšanai.14 Pacientiem, kuriem ir recidivējusi pret platīnu jutīga slimība, paklitaksels var kompensēt relatīvo platīna līmeņa samazināšanos. jutīgums. Vēl viens iespējamais izskaidrojums ir tāds, ka platīna daudzums, ko šie pacienti var saņemt otrās līnijas terapijas laikā, ir ierobežots salīdzinājumā ar daudzumu, ko viņi var saņemt pirmās līnijas terapijas laikā. Piemēram, tikai 40% mūsu pacientu saņēma vairāk nekā 90% no kopējās plānotās karboplatīna devas. Salīdzinājumam, aptuveni 75% pacientu saņēma vairāk nekā 90% no plānotās kopējās karboplatīna devas ICON3 pētījumā kā pirmās līnijas terapiju.6 Provizoriskie rezultāti Spānijas randomizētā pētījumā, kurā karboplatīns salīdzināja ar paklitakselu/karboplatīnu 81 pacientam ar tādu pašu terapiju. izmēģinājuma iekļaušanas kritēriji, tāpat kā MRC CTU protokolā, ir līdzīgi mūsu rezultātiem atbildes reakcijas ātruma, dzīvildzes bez slimības progresēšanas un toksiskās iedarbības ziņā.18 Paklitaksels kombinācijā ar platīna līdzekli parasti ir toksiskāks nekā parasts uz platīna bāzes izgatavots preparāts. ķīmijterapijas režīms, izraisot lielāku alopēciju un neiroloģisku toksisku ietekmi. Neiroloģiskā toksiskā iedarbība tika novērota 20% pacientu, kas ir līdzīgs skaitļiem, kas novēroti pirmās rindas ārstēšanā.6 Šī proporcija ir mazāka nekā gaidīts, jo īpaši tāpēc, ka viena trešdaļa pacientu iepriekš bija saņēmuši taksānu zāles. Dizon et al8 pieredze ir līdzīga, un docetaksela lietošana 3% mūsu pacientu, iespējams, ir veicinājusi, lai gan ne būtiski, mazāku perifēro neirīta procentuālo daļu. Tomēr terapijas ievērošana bija laba, 72% pacientu pabeidza vismaz sešus ārstēšanas kursus. Vēl viens iemesls, protams, varētu būt tas, ka pacienti, kuriem ir tendence attīstīties neiropātijām, netika iekļauti pētījumā, jo viņiem bija pieredze pirmās izvēles ārstēšanā. Tradicionālā platīna ķīmijterapija ir saistīta ar smagāku hematopoētisko toksicitāti nekā paklitaksela/platīna terapijas shēmas, kas apstiprina iepriekš publicētos ziņojumus, ka paklitakselam var būt aizsargājoša iedarbība uz kaulu smadzenēm.19 Atkārtota olnīcu vēža ārstēšanā ir nozīmīga paliatīvā sastāvdaļa. Tāpēc pacientam ir svarīgi novērtēt viņas dzīves kvalitāti, lai pateiktu, vai paklitaksela/platīna terapijas shēmai būs kādi trūkumi salīdzinājumā ar parasto platīna ķīmijterapiju (vai otrādi) ar ārstēšanu saistītās toksicitātes un bezsimptomu intervāla ziņā. Mēs neatradām skaidru norādi, ka kāds no izmantotajiem režīmiem būtu sliktāks par otru attiecībā uz funkcionāliem aspektiem, simptomiem vai vispārējo veselības stāvokli.
Mūsu rezultāti liecina par paklitaksela/platīna kombinācijas labvēlīgo ietekmi uz kopējo dzīvildzi un dzīvildzi bez slimības progresēšanas pacientu grupā ar recidivējošu pret platīnu jutīgu olnīcu vēzi. Paklitakselu visbiežāk kombinēja ar karboplatīnu, un visbiežāk lietotā parastā platīna ķīmijterapijas shēma ietvēra karboplatīna lietošanu kā vienu līdzekli. Tāpēc mēs uzskatām, ka visas sievietes, kurām recidīvs vairāk nekā 6 mēnešus pēc platīna bāzes ķīmijterapijas pabeigšanas, jāuzskata par kandidātēm uz platīna un paklitaksela kombinēto ķīmijterapiju, pat ja viņas saņēma paklitakselu kā daļu no pirmās izvēles ārstēšanas shēmas.
Paziņojums par interešu konfliktu J. A. Ledermans ir saņēmis nelielu īpašu konsultāciju honorāru no Bristol-Myers Squibb.
1. tabula. Randomizācijas grupas un pacientu bāzes raksturlielumi
|
Raksturīgs |
Regulāra HT |
Paklitaksels+platīns |
|
Personu skaits randomizācijas grupā |
||
|
Vecums (gadi) |
||
|
PVO funkcionālais stāvoklis |
||
|
Plānotais platīna medikaments |
||
|
Karboplatīns |
||
|
Cisplatīns |
||
|
Pēdējā ķīmijterapija |
||
|
Paklitaksels un karboplatīns |
||
|
Karboplatīns |
||
|
Paklitaksels un cisplatīns |
||
|
Docetaksels un karboplatīns |
||
|
Citas zāles uz platīna bāzes |
||
|
Citas zāles |
||
|
Iepriekšējo ķīmijterapijas līniju skaits |
||
|
Nezināms |
||
|
Laiks kopš pēdējās ķīmijterapijas pabeigšanas (mēneši) |
||
2. tabula. Ārstēšanas protokols izmēģinājuma laikā
|
Regulāra HT |
Paklitaksels+platīns |
|
|
Ārstēšana |
||
|
Karboplatīns (mono) |
||
|
Karboplatīns un cisplatīns* |
||
|
Cisplatīns un doksorubicīns |
||
|
Cisplatīns (mono) |
||
|
Karboplatīns kombinācijā (nav ar taksānu) |
||
|
Paklitaksels un karboplatīns |
||
|
Paklitaksels un cisplatīns |
||
|
Paklitaksels, karboplatīns un cisplatīns* |
||
|
Paklitaksels (mono) |
||
|
Ārstēšana nav pieejama vai nav zināma |
||
3. tabula. Vidēji smagas vai smagas blakusparādības ārstēšanas laikā
|
Toksiska iedarbība |
Regulāra HT |
Paklitaksels+platīns |
|
Neiroloģiskie (2.–4. klase) |
||
|
Nezināms |
||
|
Hematoloģiskais* |
||
|
Nezināms |
||
|
Infekcijas* |
||
|
Nezināms |
||
|
Nezināms |
||
|
Mukozīts (2./3. pakāpe) |
||
|
Nezināms |
||
|
Slikta dūša un vemšana (2.-4. pakāpe) |
||
|
Nezināms |
||
|
Alopēcija (2.-4. pakāpe) |
||
|
Nezināms |
Literatūra
1 Parkin DM, Bray FI, Devesa SS. Vēža slogs 2000. gadā: globālā aina. Euro J Vēzis 2001; 37:
S4–66.
2 ICON līdzstrādnieki. ICON2: randomizēts pētījums par viena līdzekļa karboplatīnu pret trīs zāļu kombināciju CAP (ciklofosfamīds, doksorubicīns un cisplatīns) sievietēm ar olnīcu vēzi. Lancete 1998; 352:
1571–76.
3 Uzlabotā olnīcu vēža izmēģinājumu grupa. Ķīmijterapija progresējoša olnīcu vēža gadījumā: četras sistemātiskas atsevišķu pacientu datu metaanalīzes no 37 randomizētiem pētījumiem. Br J Vēzis 1998; 78:
1479–87.
4 Markman M, Reichman B, Hakes T u.c l. Otrās līnijas platīna terapija pacientēm ar olnīcu vēzi, kas iepriekš ārstētas ar cisplatīnu. J Clin Oncol 1991; 9:
389–93.
5 Trimble EL, Adams JD, Vena D u.c l. Paklitaksels pret platīna rezistentu olnīcu vēzi: rezultāti no pirmajiem 1000 pacientiem, kas reģistrēti Nacionālā vēža institūta ārstniecības nosūtīšanas centrā 9103. J Clin Oncol 1993; 11:
2405–10 6
6 Starptautiskā olnīcu audzēju (ICON) grupa. Paklitaksels plus karboplatīns pret standarta ķīmijterapiju ar vienu līdzekli karboplatīnu vai ciklofosfamīdu, doksorubicīnu un cisplatīnu sievietēm ar olnīcu vēzi: ICON3 randomizētais pētījums. Lancete 2002; 360:
505–15.
7 Rose PG, Fusco N, Fluellen L u.c. Otrās līnijas terapija ar paklitakselu un karboplatīnu recidivējošas slimības ārstēšanai pēc pirmās izvēles terapijas ar paklitakselu un platīnu olnīcu vai peritoneālās karcinomas gadījumā. J Clin Oncol 1998; 16:
1494–97.
8 Dizon DS, Hensley ML, Poynor EA u.c. Karboplatīna un paklitaksela retrospektīva analīze kā sākotnējās otrās līnijas terapija recidivējošai epitēlija olnīcu karcinomai: pielietojums olnīcu vēža dinamiskam slimības stāvokļa modelim. J Clin Oncol 2002; 20:
1238–47.
9 Calvert AH, Newell DR, Gumbrell LA u.c. Karboplatīna deva: vienkāršas formulas perspektīvs novērtējums, pamatojoties uz nieru darbību. J Clin Oncol 1987; 7:
1748–56.
10 Parmar MKB, Machin D. Izdzīvošanas analīze: praktiska pieeja. Čičestera: Džons Vilijs, 1995.
11 Fayers PMF, Aaronson NK, Bjordal K, Curran D, Groenvold M, EORTC dzīves kvalitātes pētījumu grupas vārdā. EORTC QLQ-C30 vērtēšanas rokasgrāmata, 3. izd.
Brisele: Eiropas Vēža izpētes un ārstēšanas organizācija, 2001: 86.
12 Girling D, Parmar MKB, Stenning S, Stephens R, Stewart L. Vēža klīniskie pētījumi.
Oksforda: Oxford University Press, 2003.
13 Cantu MG, Buda A, Parma G u.c. Randomizēts kontrolēts pētījums par vienu līdzekli paklitakselu pret ciklofosfamīdu, doksorubicīnu un cisplatīnu pacientiem ar recidivējošu olnīcu vēzi, kuri reaģēja uz pirmās izvēles platīna bāzes shēmām. J Clin Oncol 2002; 20:
1232–37.
14 McGuire WP, Hoskins W, Brady MF, et al. Ciklofosfamīds un cisplatīns salīdzinājumā ar paklitakselu un cisplatīnu pacientiem ar III un IV stadijas olnīcu vēzi. N Engl J Med 1996; 334:
1–6.
15 Piccart MJ, Bertelsen K, James K u.c. Randomizēts starpgrupu pētījums par cisplatīna paklitakselu un cisplatīna ciklofosfamīdu sievietēm ar progresējošu epitēlija olnīcu vēzi: trīs gadu rezultāts. J Natl Cancer Inst. 2000; 92:
699–708.
16 Muggia FM, Braly PS, Brady MF u.c. III fāzes randomizēts pētījums par cisplatīnu pret paklitakselu pret cisplatīnu un paklitakselu pacientiem ar suboptimālu III vai IV stadijas olnīcu vēzi: ginekoloģiskās onkoloģijas grupas pētījums. J Clin Oncol 2000; 18:
106–15.
17 Sandercock J, Parmar MKB, Torri V u.c. Pirmās līnijas ārstēšana progresējoša olnīcu vēža gadījumā: paklitaksels, platīns un pierādījumi. Br J Vēzis 2002; 87:
815–24.
18 Gonzalez Martin AA, Calro E, Bover I u.c. Randomizēts II fāzes pētījums par karboplatīnu pret paklitakselu-karboplatīnu pret platīnu jutīgas recidivējošas progresējošas olnīcu karcinomas gadījumā ar dzīves kvalitātes novērtējumu: GEICO pētījums (Spānijas olnīcu karcinomas izpētes grupa). Proc ASCO 2003; 22:
(abstr 1812).
19 van Warmerdam LJ, Huizing MT, Giaccone G u.c. Karboplatīna klīniskā farmakoloģija, lietojot kombinācijā ar paklitakselu. Semin Oncol 1997; 24
(piegāde 2 ):
97–104.
Rīsi. 1. Testa profils
Rīsi. 2. Kopējā izdzīvošana 
Rīsi. 3. Izdzīvošana bez progresēšanas 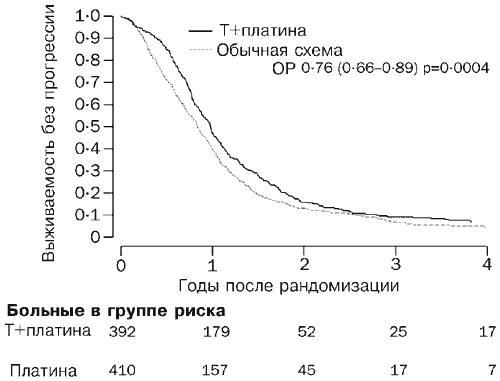
Rīsi. 4. XT kombinācijas T+platīns ietekme uz kopējo dzīvildzi apakšgrupās 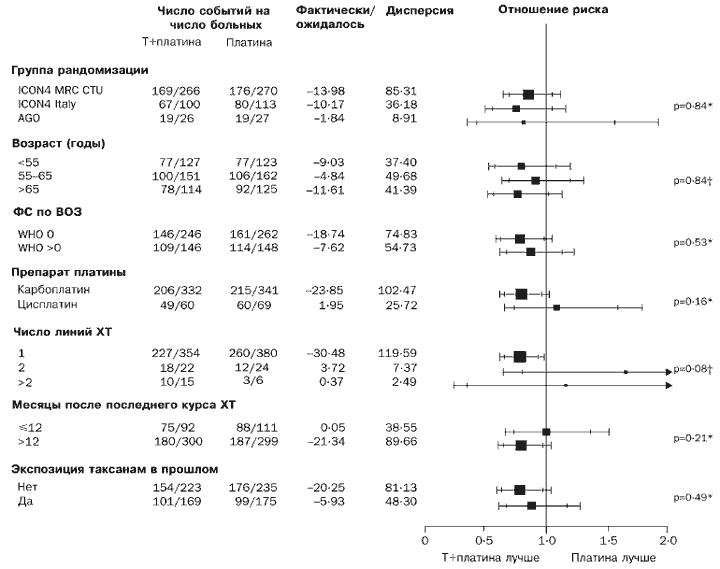
* Mijiedarbība
Tendence
Saīsinājumi: T - paklitaksels; XT - ķīmijterapija; FS - funkcionālais stāvoklis.
Attiecas uz galvenajām ļaundabīgo audzēju ārstēšanas metodēm. Ārstēšanas procesā izmantotās zāles ir vērstas uz vēža šūnu iznīcināšanu vai to vairošanās nomākšanu. Ķīmijterapijas lietošana var palielināt pacienta dzīves ilgumu un samazināt simptomu smagumu.
Cik maksā ārstēšana?
Ķīmijterapijas izmaksas ietekmē šādi faktori:
- Nosacījumi. Ārstēšanu var veikt gan slimnīcā, gan ambulatorā veidā. Uzturoties slimnīcā, izmaksas būs lielākas. Taču, pat ja ir vēlme samazināt ķīmijterapijas kursa izmaksas, jārēķinās, ka ne vienmēr ir iespējams veikt efektīvu ārstēšanu ambulatorā veidā.
- Zāļu cena. Ārstēšanai tiek izmantotas vairākas dažādas zāļu kategorijas. Var lietot ne tikai oriģinālos medikamentus, bet arī ģenēriskos – līdzīga sastāva, bet cita uzņēmuma ražotus medikamentus. Šādi analogi ir lētāki.
- Ārstēšanas protokols. Viena un tā paša veida audzēja ārstēšanas shēmas var atšķirties un ietvert: dažādi saraksti zāles. Tāpēc, izrakstot ķīmijterapiju, izmaksas var atšķirties atkarībā no zāļu kombinācijas.
- Papildu ārstēšana un papildu procedūras. Īpaša apmācība var būt nepieciešama pirms ķīmijterapijas: tas ir nepieciešams, lai samazinātu blakusparādību risku un samazinātu to intensitāti. Ārstēšanas laikā jāveic uzturošā terapija, kā arī zāles pēc kursa pabeigšanas, lai atjaunotu traucētās funkcijas.
- Izmantojot citas metodes. Papildus ķīmijterapijai pacientam var būt nepieciešama arī cita medicīniskā aprūpe: veicot ķirurģiska iejaukšanās, staru terapija, mērķtiecīgu zāļu lietošana, hormonālās zāles. Atkarībā no šo metožu saraksta vēža ķīmijterapijas izmaksas būs atšķirīgas.
Narkotikas, kuras var lietot
Ķīmijterapijas laikā var lietot šādas zāļu grupas:
- alkilēšana;
- antraciklīni;
- platīna atvasinājumi;
- pretvēža līdzekļi;
- vinkalkaloīdi;
- citostatiskie līdzekļi;
- taksāni.
Jāņem vērā, ka ķīmijterapijā lietotās zāles iedarbojas pret aktīvajām šūnām. Tas nozīmē, ka, ja ir liels daudzumsšūnu struktūras, kas atrodas miega fāzē, audzējs var būt diezgan izturīgs pret to ietekmi.
Alkilējošie līdzekļi
Zāļu ietekmē audzēja šūnas mirst noteiktu olbaltumvielu sintēzes nomākšanas dēļ.
Šo zāļu lietošanas risks ir leikēmijas iespējamība.
Alkilēšanas līdzekļi ietver:
- Ciklofosfamīds;
- Embikhins;
- ifosfamīds;
- Hlorambucils.
Tālāk ir sniegti ķīmijterapijā izmantoto šīs kategorijas zāļu piemēri, kuru cena ir atšķirīga:
- vinblastīns;
- Vinkristīns;
- Vinorelbīns.
Pretvēža antibiotikas
Zāles, kas paredzētas vēža šūnu gēnu dalīšanās palēnināšanai. Blakusparādības, lietojot šīs kategorijas medikamentus, visbiežāk rodas saistībā ar plaušu struktūrām, jo izrādās toksiska iedarbība uz plaušām.
Visbiežāk lietotie: Adriamicīns, Bleomicīns. Visizplatītākā ir kombinācija ar citotoksīnu.
- mitomicīns;
- Epirubicīns.
Antraciklīni
Tās ir vielas, kas bojā vēža šūnu DNS. Antraciklīni ietver daunorubicīnu un doksorubicīnu. Tās ir zāles, kas izgatavotas no dabīgām izejvielām. Aktīvā viela ir augsnes sēņu sastāvdaļa. Antraciklīni ir zāles, kas parāda savu efektivitāti cīņā pret vēža šūnām, taču tām ir arī daudzas blakusparādības, kas saistītas ar sirds un asinsvadu sistēmas darbību.
- adriblastīns;
- Zavedos;
- Doksorubicīns.
Antimetabolīti
Vielas, kas ir integrētas ģenētiskajā šūnas kods. Izmaiņas, kas rodas, sadalīšanās procesā izraisa šūnu nāvi.
Šīs kategorijas zāles: Metotreksāts, Gemzar, Gemcitabīns. Viens no plaši izmantotajiem līdzekļiem ir 5-fluoruracils. Tas jau sen ir izmantots vēža audzēju ķīmijterapijā un ir pierādījis savu efektivitāti, taču tam ir raksturīgas arī blakusparādības. Tas var ietekmēt kaulu smadzenes, izraisīt kuņģa-zarnu trakta intoksikāciju, neirotoksīnu veidošanos, kas izraisa krampjus un komu.
Ja ķīmijterapija ir nepieciešama, zāļu cena var būt galvenais faktors, kas nosaka izvēli. Antimetabolīti aptiekā tiek piedāvāti dažādās cenu kategorijās:
- Metotreksāts;
- Fluoruracils;
- Xeloda;
- Merkapturīns.
Platīna atvasinājumi
Tie ir klasificēti kā smagie toksiskie metāli. Visbiežāk:
- Cisplatīns (tam ir spēcīga toksiska iedarbība uz nierēm);
- Karboplatīns (2. paaudzes zāles, toksiska iedarbība mazāk);
- Oksaliplatīns (3. paaudzes zāles, nieres negatīvi neietekmē, bet var izraisīt neiropātijas).
Citostatiskie līdzekļi
Citostatiskie līdzekļi darbojas pēc alkilējošo vielu jeb antimetabolītu principa. Visizplatītākie ir kapecitabīns un taksols.
Taksāni
Taksānus lieto plaušu vēža ārstēšanai, un. Blakusparādība ir asins šūnu kvalitātes pazemināšanās.
Zāles, ko lieto atveseļošanai pēc ķīmijterapijas
Atveseļošanās nolūkā tiek nozīmētas tradicionālās zāles un augu izcelsmes zāles. Atjaunojošo terapiju var uzsākt ķīmijterapijas laikā vai uzreiz pēc tās.
Kritiski samazinās leikocītu līmenis, ievērojami samazinās imunitāte. Atveseļošanās imūnā funkcija Tiek izmantots imunofols un polioksidonijs.
Ja nav vajadzīgā efekta, tos aizstāj ar spēcīgākām zālēm: Batilol, Leukogen, Cefaransin, Methyluracil.
Aknas ir pakļautas ļoti nopietnam stresam, jo tām ir jāizvada milzīgs daudzums toksīnu. Atkopšanas lietošanai:
- Hepasterils;
- Hepamīns;
- Sirepar;
- Karsils.
Nieru darbības traucējumi izpaužas kā pastāvīga vemšana un caureja. Orgānu atjaunošana tiek veikta ar Uroprot, Uromethoxan palīdzību.
Sirds un asinsvadu sistēmas atjaunošanai izmanto: Asparkam, Preductal, Mildrokart.
Daudzas blakusparādības ķīmijterapijas laikā attīstās zarnās un gremošanas sistēmā. Katrs pacients saskaras ar sliktu dūšu, vemšanu un caureju. Zāļu lietošanu pavada iekaisuma process zarnās, un šodien nav zāļu, kas varētu pilnībā novērst iekaisumu.
Atveseļošanai lietojiet tādas zāles kā:
- starpniekserveris;
- Nexium;
- Kvamatel.
Depresijas profilakse. Zāļu kombinācijas dēļ ķīmijterapijas laikā attīstās divpadsmitpirkstu zarnas depresija. Tas rodas vairāku hormonu sintēzes dēļ divpadsmitpirkstu zarnā. Iekaisums izraisa neiropeptīdu nelīdzsvarotību.
Lietotās zāles:
- Afabazols;
- Fezam.
No kā vēl ir atkarīgas izmaksas?
Ķīmijterapija tiek veikta kursos. Pēc viena kursa pabeigšanas ir nepieciešams pārtraukums atveseļošanai. Ciklu ilgums un skaits, kopējais ārstēšanas ilgums būs atkarīgs no vēža veida, stadijas un lietotajām zālēm. Tas viss ietekmēs ārstēšanas cenu kopumā. Ķīmijterapijas izmaksas ir atkarīgas no zāļu formas un ārstēšanai nepieciešamā apjoma.
Papildus zāļu cenai, kas ne vienmēr veido lielāko izmaksu daļu, medicīnas centru izsludinātā vēža ķīmijterapijas cena paredz pakalpojumu apmaksu, neņemot vērā medikamentus.
Šeit arī jāatzīmē, ka var būt būtiska atšķirība starp cenām valdības centros un privātajās klīnikās.
Ķīmijterapijas izmaksas Maskavā ir atkarīgas no izvēlētās iestādes, un tās iedala šādos veidos:
- frakcionēta ķīmijterapijas zāļu ievadīšana (ķīmijterapijas cena par 1 kursu);
- ķīmijterapijas zāļu infūzija;
- dozētas infūzijas;
- 24 stundu ķīmijterapijas infūzijas.
Ārstēšanas ilgums
Ķīmijterapiju parasti ievada intravenozi. Vidējais ārstēšanas ilgums ir 2-3 nedēļas.
Plaušu onkoloģija – intravenoza ārstēšana, ilgums – 2,3,4 nedēļas.
Dzemdes onkoloģija. Tiek izmantotas Taxol, Doxorubicin, Carboplatin, Cisplatin kombinācijas.
Parasti tiek lietotas 2 vai vairāk zāles.
Olnīcu onkoloģija. Platīna preparātus ieteicams lietot kombinācijā ar Paklitakselu, Docetakselu. Ietver intravenozu ievadīšanu.
Kuņģa onkoloģija. Zāles var lietot iekšķīgi vai intravenozi. Ārstēšanas cikla ilgums var būt 14, 21, 28 dienas.
Ja ķīmijterapiju veic ārzemēs, izmaksas būs lielākas. Piemēram, ķīmijterapijas izmaksas Vācijā ir aptuveni šādas:
- audzējs saistaudi par 7 dienu uzturēšanos klīnikā ļoti sarežģītai terapijai - no 6 līdz 12 tūkstošiem eiro;
- vietējai ķīmijterapijai – no 4 līdz 7,5 tūkstošiem eiro;
- vidēji sarežģīta ķīmijterapija – 4,5-7,5 tūkstoši eiro.
Šajā gadījumā jums jāpievieno ceļa izdevumi.
Ķīmijterapijas izmaksas, cita starpā, būs atkarīgas no slimības stadijas. Ja audzējs ir maza izmēra un tam vēl nav izveidojušās metastāzes, ārstēšana būs vieglāka un ātrāka. Tāpat kā ar jebkuru citu slimību, ir ļoti svarīgi pēc iespējas ātrāk atklāt audzēju un nekavējoties rīkoties. Ar ārstēšanu nevajadzētu atlikt, ja tiek atklāts audzējs, nekavējoties jāpiesakās pie onkologa.
Catad_tema Onkoloģija - raksti
Paraplatīns: kādas ir otrās paaudzes platīna atvasinājumu priekšrocības?
Onkoloģija
Kompilācija: S.A. Tyulyandin
Nosaukts Onkoloģisko pētījumu centrs. N.N.Blohins RAMS
Šis dokuments ir izstrādāts, lai atbildētu uz jautājumiem, ko ārsti varētu sagaidīt par Bristol-Myers Squibb onkoloģijas zālēm.
Šajā rakstā izteiktie viedokļi ir autora personīgie uzskati, un tie nav paredzēti, lai pārstāvētu Bristol-Myers Squibb oficiālo nostāju.
Daļa šajā instrukcijā ietvertās informācijas var atšķirties no Bristol-Myers Squibb ieteiktajām devām, indikācijām un ievadīšanas ceļiem. Šajā sakarā, lai iegūtu pilnīgu informāciju, lūdzu, skatiet zāļu lietošanas instrukcijas.
Sīkāku informāciju par Bristol-Myers Squibb pretvēža zālēm var iegūt Uzņēmuma Krievijas pārstāvniecībā.
Platīna atvasinājumu nozīme
Lielākā daļa efektīvas zālesārstēšanas laikā:
- nesīkšūnu plaušu vēzis;
- sīkšūnu plaušu vēzis;
- plakanšūnu karcinoma dažādas lokalizācijas(galvas un kakla, barības vada, dzemdes kakla vēzis);
- olnīcu vēzis;
- olnīcu audzēji;
- osteogēna sarkoma.
Kāpēc ir vajadzīgas analogās zāles?
- palielināta pretvēža aktivitāte
- darbības spektra paplašināšana
- samazināta toksicitāte
- ārstēšanas izmaksu samazināšana
No šīs perspektīvas aplūkosim divus onkologiem pieejamos platīna atvasinājumus: cisplatīnu, pirmās paaudzes zāles un paraplatīnu, otrās paaudzes platīna atvasinājumu.
Cisplatīns un paraplatīns ir vienlīdz efektīvi, ārstējot:
- nesīkšūnu plaušu vēzis
- sīkšūnu plaušu vēzis
- olnīcu vēzis
Cisplatīns un paraplatīns ir vienlīdz efektīvi olnīcu vēža gadījumā
SWOG pētījums – Alberts D. 1992.gNCIC pētījums - Swenerton K. 1992
Saskaņā ar Dienvidaustrumu Onkoloģijas grupas (SWOG) un Kanādas Nacionālā vēža institūta (NCIC) pētījumu, cisplatīna-ciklofosfamīda un paraplatīna-ciklofosfamīda kombinācija ir vienlīdz efektīva, ārstējot pacientus ar III-IV stadijas olnīcu vēzi. Objektīvais efekts bija attiecīgi 50-57% un 59-61%, ar vienādu paredzamo dzīves ilgumu.
Cisplatīna paraplatīns ir vienlīdz efektīvs sīkšūnu vēzis plaušu
Buns R.1992Sīkšūnu plaušu vēža gadījumā tika reģistrēta tāda pati pretvēža aktivitāte kombinācijām cisplatīns - etopozīds un paraplatīns - etopozīds. Tajā pašā laikā kombinācijai ar paraplatīna iekļaušanu ir mazāka toksicitāte.
Cisplatīns un paraplatīns ir vienlīdz efektīvi nesīkšūnu plaušu vēža gadījumā
Klasterskis J. 1990Līdzīgi rezultāti, kaut arī pieticīgāki pretvēža aktivitātes ziņā, tika iegūti, ārstējot pacientus ar nesīkšūnu plaušu vēzi.
Platīna atvasinājumu pretvēža aktivitātes salīdzinājums
Cisplatīns un paraplatīns ir vienlīdz efektīvi, lietojot līdzvērtīgas devas
Cisplatīns un paraplatīns var būt vienlīdz efektīvi, ja abu zāļu devas ir līdzvērtīgas: cisplatīna deva 100 mg/m2 atbilst paraplatīna devai 400 mg/m2.
Cisplatīna aizstāšana ar paraplatīnu samazina ārstēšanas efektivitāti pacientiem:
- sēklinieku vai olnīcu dzimumšūnu audzēji
- galvas un kakla plakanšūnu karcinoma
Pretvēža iedarbības spektra salīdzinājums
Cisplatīnam un paraplatīnam ir vienāds pretvēža iedarbības spektrs
Paraplatīns ir viena no populārākajām zālēm lielu devu ķīmijterapijai ar sekojošu kaulu smadzeņu hematopoēzes atjaunošanu.
Cisplatīnam un paraplatīnam ir vienāds pretvēža iedarbības spektrs. Var atzīmēt, ka atšķirībā no cisplatīna paraplatīns ir viena no populārākajām zālēm lielu devu ķīmijterapijai ar sekojošu kaulu smadzeņu hematopoēzes atjaunošanu.
Indikācijas cisplatīna aizstāšanai ar paraplatīnu
- pavājināta nieru darbība vai augsta riska nefrotoksicitāte
- neirotoksicitātes pazīmes vai augsts tās attīstības risks
- smaga slikta dūša un vemšana, lietojot cisplatīnu
- ģenerālis slikts stāvoklis pacients
- ambulatorās ārstēšanas nepieciešamība
Platīna atvasinājumu toksicitātes salīdzinājums
Viltšovs E. 1985Šajā tabulā ir sniegts frekvenču salīdzinājums dažādas komplikācijas lietojot cisplatīnu un paraplatīnu pacientēm ar progresējošu olnīcu vēzi. Šajā pētījumā nieru darbība tika novērtēta pēc radioaktīvi iezīmētā EDTA nieru filtrācijas ātruma. Nieru filtrācijas samazināšanās tika novērota ievērojami biežāk, ordinējot cisplatīnu. Ārstēšana ar paraplatīnu retāk bija saistīta ar vemšanu, perifēra neiropātija, dzirdes zudums, anēmija, savukārt leikopēnija un trombocitopēnija bija biežākas komplikācijas, salīdzinot ar cisplatīnu.
Ārstēšanas izmaksas
Cisplatīna augstāka toksicitāte atspoguļojas ārstēšanas izmaksās, jo tam nepieciešama uzturēšanās slimnīcā, hidratācija un pēchidratācija, pretvemšanas līdzekļu izrakstīšana, parasti vairākas dienas, un nieru darbības stāvokļa kontrole pēc zāļu ievadīšanas.
Ārstēšanas izmaksas
Kalverts A.H. 1991. gads
Paraplatīna izrakstīšana cisplatīna vietā samazina ārstēšanas izmaksas gan Apvienotajā Karalistē, gan ASV, neskatoties uz to, ka paša paraplatīna cena ir ievērojami augstāka nekā cisplatīna cena. Ārstēšanas izmaksu atšķirības šajās divās valstīs ir izskaidrotas vairāk augstas izmaksas uzturēšanās slimnīcā ASV.
Paraplatīns: devas aprēķināšana
- ķermeņa zona
- nieru darbība, jo zāles izdalās caur nierēm
Konkrētas zāles veiksmīga lietošana lielā mērā ir atkarīga no pareizas devas izvēles. Saskaņā ar oficiālajiem ražotāja ieteikumiem paraplatīna devu aprēķina, ņemot vērā pacienta ķermeņa virsmas laukumu un nieru funkcionālo stāvokli, ko raksturo kreatinīna klīrensa vērtība. Paraplatīna devu samazina, jo kreatinīna klīrenss samazinās, un, ja pēdējais ir mazāks par 15 ml/stundā, zāļu lietošana ir kontrindicēta.
Kreatinīna klīrenss (Rehberga tests)
kreatinīna koncentrācija urīnā/
kreatinīna koncentrācija serumā
X
minūtes diurēze
=
kreatinīna klīrenss
(glomerulārās filtrācijas ātrums)
Ir lietderīgi atgādināt, ka kreatinīna klīrensu nosaka, izmantojot Rehberg testu. Lai to izdarītu, pacients savāc ikdienas urīnu. Minūtes diurēzi nosaka, dalot ikdienas urīna daudzumu ar urīna savākšanas laiku minūtēs. Pēc tam tiek noteikta kreatinīna koncentrācija ikdienas urīnā un asins serumā. Šo vērtību dalīšanas rezultāts tiek reizināts ar minūtes diurēzi, kas galu galā dod kreatinīna klīrensa skaitli, kas ir svarīgs glomerulārās filtrācijas līmeņa rādītājs.
Kreatinīna klīrenss (Cockcroft formula)
K x (140 - vecums) x svars kg/
seruma kreatinīns
K = 1,05 sievietēm
K = 1,23 vīriešiem
Cockroft & Gault 1976
Kreatinīna klīrensu var noteikt arī, izmantojot Kokkrofta formulu, zinot kreatinīna koncentrāciju serumā, pacienta vecumu, svaru un dzimumu. Šī ir ērtāka, ātrāka un, kā liecina īpaši pētījumi, diezgan precīza klīrensa noteikšanas metode.
Paraplatīns: devas aprēķināšana
pavājināta nieru darbība
zāļu dzīves ilguma pagarināšana asinīs
palielinot laiku, kad zāles iedarbojas uz kaulu smadzenēm
leikotrombocitopēnija
Kāpēc, ievadot paraplatīnu, ir svarīgi pareizi novērtēt nieru funkcionālo stāvokli? Nieru filtrācijas līmeņa pazemināšanās palielina paraplatīna cirkulācijas ilgumu asinīs, tādējādi palielinot zāļu iedarbības laiku uz kaulu smadzenēm. Tā sekas ir palielināta hematoloģiskā toksicitāte, kas izpaužas kā leikotrombocitopēnijas attīstība.
AUC (mg min/ml) = C mg/ml X t min
Lai realizētu pretvēža efektu, ir nepieciešams uz noteiktu laiku radīt noteiktu zāļu koncentrāciju asinīs. Šis attēls parāda, kas notiek ar paraplatīnu, kad to ievada intravenozi. Koncentrācijas līkne vispirms palielinās un pēc tam samazinās, jo zāles izdalās caur nierēm. Platība zem līknes jeb AUC (angļu valodas saīsinājums Area Under the Curve) ir atvasinājums no zāļu koncentrācijas asinīs noteiktā laika periodā. Ja nieru darbība ir vienāda, AUC būs lielāks pacientiem, kuri saņem lielāku devu. Lietojot tādas pašas zāļu devas, pacientiem ar pavājinātu nieru ekskrēcijas funkciju tiks iegūts lielāks AUC.
Paraplatīna farmakokinētikas iezīmes: laukums zem līknes (AUC)

Noteikts AUC = 5-7,5 mg
X min/ml ir optimāls pretvēža aktivitātes un toksicitātes ziņā
AUC vērtība ir tieši atkarīga no vienas paraplatīna devas un nieru darbības. Turklāt AUC vērtība korelē ar zāļu pretvēža aktivitāti un toksicitāti. Jo augstāka ir AUC vērtība, jo izteiktāka ir zāļu pretvēža iedarbība, īpaši pacientiem ar sēklinieku dzimumšūnu audzējiem. Tomēr AUC palielināšanos ierobežo hematoloģiskās toksicitātes attīstība. Tika noteikts, ka optimālā AUC vērtība ir robežās no 5-7,5 mg x ml/min no efektivitātes un toksicitātes viedokļa. Pamatojoties uz šiem datiem, tika izstrādāta cita metode paraplatīna devas aprēķināšanai, ņemot vērā vēlamo AUC vērtību un pacienta nieru funkcionālo stāvokli.
Paraplatīns: devas aprēķināšana
Kalverta formula
Paraplatīna deva (mg) = AUC x (GRF + 25)
GRF - glomerulārās filtrācijas ātrums
Paraplatīna deva (mg) = AUC x (kreatinīna klīrenss + 25)
Dr. Kalverts no Apvienotās Karalistes ierosināja formulu vienas paraplatīna devas aprēķināšanai, kurā vēlamais AUC tiek reizināts ar glomerulārās filtrācijas ātruma (GRF) summu plus 25. Sākotnēji glomerulārās filtrācijas ātrumu noteica ar radioizotopu metodi. . Tagad ir atzīts, ka Kalverta formulā glomerulārās filtrācijas ātruma vietā ir iespējams izmantot kreatinīna klīrensa indikatoru, kas noteikts vai nu ar Rehberga testu, vai aprēķināts, izmantojot Kokkrofta formulu. Svarīgi atcerēties, ka pēc Kalverta formulas paraplatīna devu aprēķina mg, nevis mg/m2.
Paraplatīns: devas aprēķins, izmantojot Kalverta formulu
Paraplatīna deva, kas aprēķināta, ņemot vērā AUC, vairāk korelē ar zāļu pretaudzēju un toksisko iedarbību, salīdzinot ar empīrisko devu (mg/m2).
Diriģēts klīniskie pētījumi parādīja, ka paraplatīna deva, kas aprēķināta, ņemot vērā AUC, vairāk korelē ar zāļu pretaudzēju un toksisko iedarbību, salīdzinot ar empīrisko devu (mg/m2). Tādējādi, aprēķinot paraplatīna devu, izmantojot Calvert formulu, jūs panākat individuālu devas izvēli, kas ir optimāla konkrētam pacientam pretaudzēju efektivitātes un toksicitātes ziņā.
Paraplatīns: kādas ir otrās paaudzes platīna atvasinājumu priekšrocības?
- vienāda pretaudzēju aktivitāte
- tāds pats pretvēža aktivitātes spektrs
- mazāka toksicitāte
- zemākas ārstēšanas izmaksas
- spēja noteikt devu, pamatojoties uz galvenajiem farmakokinētiskajiem parametriem
Lūdzu, ņemiet vērā, ka pretvēža antibiotikām nav nekā kopīga ar tradicionālajām antibiotikām. Antibiotiku darbības princips ir balstīts uz vēža šūnu gēnu dalīšanās palēnināšanu. Populārākā narkotika šajā grupā ir Adriamicīns. Šīs zāles lieto kopā ar citotoksīnu.
Antimetabolīti
Šo zāļu darbības princips ir balstīts uz integrāciju vēža šūnas ģenētiskajā aparātā. Kad vēža šūna sāk dalīties, zāles to nogalina. Šajā kategorijā ietilpst: 5-fluoruraci un gemcitabīns (Gemzar).
Antraciklīni
Šīs grupas narkotikas satur antraciklīna gredzenu, kas mijiedarbojas ar vēža šūnu DNS. Ķīmijterapijas zāles inhibē topoizomerāzi II un rada brīvos radikāļus, kas bojā vēža šūnu DNS struktūru. Šīs narkotiku grupas pārstāvji: Rubomicīns, Adriblastīns.
Vincalkaloīdi
Augu izcelsmes ķīmijterapijas zāles (ārstniecības augs Vinca rosea). Darbības mehānisms ir balstīts uz tubulīna proteīna saistīšanos, kas veido citoskeletu. Citoslekets ir neatņemama šūnas sastāvdaļa, kas tiek novērota mitozes laikā un atpūtas fāzē. Citoskeleta iznīcināšana izraisa hromosomu migrācijas traucējumus šūnu dalīšanās laikā, kas izraisa šūnu nāvi. Šīs zāles īpatnība ir tāda, ka vēža šūnas ir jutīgākas pret tās darbību nekā veselās. Pateicoties tam, zālēm ir minimālas blakusparādības. Šajā narkotiku grupā ietilpst: Vinblastīns, Vindesīns, Vinkristīns.
Platīna preparāti
Platīns ir smagais metāls, kas ir toksisks cilvēka ķermenis. Platīna darbības mehānisms ir līdzīgs alkilējošo vielu iedarbībai. Pēc norīšanas zāles mijiedarbojas ar DNS šūnām, iznīcinot to struktūru un funkcijas.
Epipodofilotoksīni
Tie ir mandraga ekstrakta sintētiskie analogi. Zāles iedarbojas uz kodolenzīmu topoizomerāzi-II un DNS. Šīs grupas zāles: Tenipozīds, Etopizīds.
Citi citostatiskie līdzekļi
Viņiem ir apvienots darbības princips, kas ir līdzīgs visām iepriekš aprakstītajām zālēm. Tādējādi daži citostatiskie līdzekļi pēc to darbības mehānisma ir līdzīgi alkilējošiem līdzekļiem (prokarbizīns, dakarbazīns), daži inhibē topoizomerāzi, bet daži darbojas kā antimetabolīti (hidroksiurīnviela). Kortikosteroīdiem ir labas citostatiskās īpašības, ko izmanto arī ārstēšanai onkoloģiskās slimības.
Taksāni
Šīs zāles iedarbojas uz mikrotubulām. Taksānu kategorijā ietilpst: Paklitaksels, Docetax un taksāni ar funkcionālām īpašībām. Ķīmijterapijas zāles stabilizē mikrotubulas un novērš to depolimerizāciju. Tas pārkāpj normāls process mikrotubulu pārstrukturēšana šūnā, kas ir būtiska vēža šūnu dalīšanās procesam.
Katrai no iepriekš minētajām ķīmijterapijas zāļu grupām ir savas īpašības, darbības princips un blakusparādības. Turklāt katras zāles lietošanai onkologi izstrādā specializētus ārstēšanas protokolus. Protokoli ir efektīvi pat ar minimālu negatīvu ietekmi uz ķermeni. Visi ārstēšanas protokoli tiek pastāvīgi pilnveidoti pasaules labākajās onkoloģijas klīnikās. Tas palielina vēža pacientu izdzīvošanas līmeni un uzlabo viņu dzīves kvalitāti.
Zāles atveseļošanai pēc ķīmijterapijas
Zāles atveseļošanai pēc ķīmijterapijas kursa ir zāles, kas ļauj atjaunot veselību un mazināt ķīmijterapijas blakus simptomus. Rehabilitācijas procesu var izmantot kā tradicionālu medikamentiem, un augu izcelsmes zāles. Atveseļošanās kurss tiek sastādīts katram pacientam individuāli. Ārstēšanu ieteicams sākt uzreiz pēc ķīmijterapijas kursa pabeigšanas vai vienlaikus ar ķīmijterapijas lietošanu, lai mazinātu blakus simptomus un aizsargātu orgānus no pretvēža zāļu iedarbības.
Patoloģisks stāvoklis vai ķīmiska slimība attīstās vienas vai vairāku zāļu lietošanas dēļ. Slimību sauc par zāļu blakusparādībām, jo tās ir daļa no to darbības mehānisma. Atveseļošanās pēc ķīmijterapijas kursa vai ķīmisko slimību profilakse ir atkarīga no ķīmijterapijas veida un vēža skartajiem orgāniem.
Apskatīsim visefektīvākās zāles atveseļošanai pēc ķīmijterapijas un skarto orgānu atveseļošanās procesu:
- Nieru atveseļošanās
Pēc ķīmijterapijas kursa nieru bojājumu gadījumā pacienti cieš no pastāvīgas vemšanas un caurejas. Tas ir ļoti bīstams stāvoklis, jo kopā ar vemšanu un caureju no organisma lielos daudzumos izdalās sālsskābe un nātrija hlorīds, bez kura nav iespējama normāla virsnieru un nieru darbība. Virsnieru dziedzeri pārstāj ražot hormonu adrenalīnu, glikortikoīdus un mineralokortikoīdus. Šādi simptomi atbilst akūts kurssķīmiska slimība. Lai atjaunotu nieres, tiek izmantotas tādas zāles kā Uroprot, Uromethoxan.
- Asins atjaunošana
Rādītāji, piemēram, vispārējais asins aina, asins bioķīmija, ESR un leikocītu formula ir indikatori, kas ir atbildīgi par veselīgs stāvoklis asinis un visi orgāni. Tieši pēc šiem kritērijiem tiek novērtēta ķīmijterapijas efektivitāte un vispārējais stāvoklis pacients. Ja pacients ir izvairījies no pirmās ķīmiskās slimības stadijas, tad drīz sākas otrā, kas ilgst līdz 7 dienām. Šajā periodā pacientiem rodas pietūkums, infiltrācija, nekroze un epitēlija iznīcināšana kuņģa-zarnu trakta un asni kaulu smadzenes.
Šo stāvokli pavada eritrocītu asnu nāve kaulu smadzenēs, kas izraisa masīvus vielmaiņas procesus. Rezultāts ir anēmija, trombocitopēnija, leikopēnija. Pacientiem ir asiņošana, zilumi un iespējama asiņošana iekšējos orgānos. Asins atjaunošanas process sastāv no sarkano asins šūnu un trombocītu pārliešanas un kā radikālas terapijas kaulu smadzeņu transplantācijas. Bet šādam atjaunošanas procesam ir savi trūkumi. Apmēram 45% pacientu inficējas ar C, B hepatītu un citiem vīrusiem, kas viņus pavada visu mūžu. Ir vairākas zāles, kas ļauj atjaunot asinis pēc ķīmijterapijas: Filstim, Neupogen, Zarsium, Grastim.
- Mikrofloras atjaunošana un imūnsistēma
Uz novājinātas imūnsistēmas fona pēc ķīmijterapijas kursa pacientiem sāk attīstīties infekcija, un oportūnistiskā flora iegūst patogēnas īpašības. Vispārējas ķermeņa intoksikācijas dēļ pacienti cieš no sēnīšu infekcijām. Tātad 100% gadījumu pacientiem attīstās kandidoze. Ir iespējams attīstīt stafilokoku, kas izplatās visā mazākās artērijas. Sakarā ar to pacientam veidojas iekaisuma perēkļi, vairāki bojājumi nekroze ar ādas perforāciju, sepsi, asiņošanu un trombozi.
70% gadījumu prombūtne rehabilitācijas terapija noved pie nāves. Lai novērstu iepriekš aprakstītā stāvokļa attīstību, atjaunotu imunitāti un mikrofloru, pacientiem tiek nozīmētas tādas zāles kā: Lacta, Latium, Laktovit-Forte, B vitamīni, Neirorubīns, Askorbīnskābe.
- Aknu atjaunošana
Pēc ķīmijterapijas kursa orgānu un sistēmu darbība un organisma audu un orgānu rezerves iespējas ir atkarīgas no aknu darbības efektivitātes. Aknu audi ir galvenais buferis vielu apstrādei, izvadīšanai un saņemšanai no organisma. Jebkuras ķīmijterapijas zāles vai vienkārši zāles, kas tiek ievadītas organismā, tiek izvadītas aknās un ietekmē aknu darbību.
Aktīvajām vielām un to metabolītiem ir tieša, spēcīga ietekme uz aknām, un netieša ietekme ir to pavadošā iedarbība organismā. Tādējādi asins parametru izmaiņas apgrūtina hepatocītu darbību, bojā nieres un rada lielu toksisko vielu slodzi aknām. Aknu šūnas var tikt bojātas infekcijas dēļ. Lai atjaunotu aknas, tiek izmantotas šādas zāles: Gepadif, Glurorgin, Karsil, Essentiale Forte-N.
- Sirds un asinsvadu sistēmas atjaunošana
Daudzi pacienti pirms operācijas vai pirms ķīmijterapijas cieš no veģetatīvās-asinsvadu distonijas un hipertensijas. Bet pēc toksīnu avota, tas ir, audzēja, noņemšanas spiediens stabilizējas. Piemēram, doksorubicīns rada brīvos radikāļus, kas palielina membrānas bojājumus. Šī iemesla dēļ zāles tiek uzskatītas par vienu no kardiotoksiskākajām. Lai atjaunotu sirds un asinsvadu sistēmu pēc ķīmijterapijas, tiek izmantotas tādas zāles kā Asporcam, Preductal, Mildrocart.
- Zarnu un gremošanas sistēmas atjaunošana
Ķīmijterapijas negatīvā ietekme ir visizteiktākā zarnās. Pacienti cieš no vemšanas, sliktas dūšas un caurejas. Bet šodien nav līdzekļu, kas pilnībā aizsargātu zarnu gļotādu no iekaisuma procesa. Tādēļ pacienti sūdzas par jostas sāpēm, gremošanas traucējumiem, apetītes trūkumu, caureju, vaļīgi izkārnījumi, caureja, kolīts, aizcietējums. Dažiem pacientiem gremošanas sistēmas un zarnu darbības traucējumu dēļ parādās kandidoze, dispepsija un disbioze. Tā kā iekaisušās zarnas nespēj pilnībā sagremot pārtiku, atveseļošanai pēc ķīmijterapijas kursa tiek izmantotas tādas zāles kā Lacta, Proxium, Nexium, Kvamatel.
- Depresijas profilakse
Ļoti bieži pēc ķīmijterapijas pacientiem zāļu mijiedarbības dēļ attīstās depresija, kas izpaužas kā duodenīts. Divpadsmitpirkstu zarnas depresija rodas, jo divpadsmitpirkstu zarnā veidojas ne tikai gremošanas hormoni, bet arī vispārējie hormoni, kas ietekmē cilvēka uzvedību. Iekaisuma procesa dēļ tiek izjaukts neiropeptīdu līdzsvars. Lai cīnītos pret šo slimību, tiek izmantotas tādas zāles kā Afabazol, Fezam un citi.
Rehabilitācijas ārstēšana sastāv no steroīdu un nesteroīdo pretiekaisuma līdzekļu, antihipoksantu, antioksidantu, pretsāpju līdzekļu un vitamīnu grupu zāļu lietošanas. Bet zāļu terapija ne vienmēr sniedz vēlamos rezultātus. Daudzi pacienti dod priekšroku ķermeņa atjaunošanai ar dabisko un drošas metodes. Šiem nolūkiem tiek izmantotas pievienotās augu izcelsmes zāles un tiek veikta augu dziedināšana.
Papildu augu izcelsmes zāles ir augu ekstraktu izmantošana, kam ir augsta pretiekaisuma aktivitāte. Augu ārstēšanas process sastāv no fitodetoksikācijas un ārstniecības augu dziedināšanas visos vēža pacienta ārstēšanas posmos. Terapija sastāv no starojuma un ķīmijterapijas ilgstošas iedarbības novēršanas, kā arī slimības recidīvu novēršanas.
Platīna zāles ķīmijterapijai
Platīna preparāti ķīmijterapijai ir mūsdienīga un efektīva vēža ārstēšanas metode. Piemēram, populārākās platīna zāles Cisplatīns tika pārbaudītas tālajā 1978. gadā ASV. Sākotnēji zāles tika izstrādātas sēklinieku vēža ārstēšanai, bet šodien tās lieto plaušu vēža, olnīcu vēža un limfomas ārstēšanai. Bet pat platīna zāles izraisa blakusparādības, kas izpaužas kā izteikta toksiska iedarbība un zāļu rezistences veidošanās šūnu līmenī.
Vēža pacientu vidū valda uzskats, ka, ja viņi sāk lietot platīna preparātus, tad viss ir ļoti slikti. Bet patiesībā tā nav. Platīna ķīmijterapija tiek izmantota, ja citas zāles nav devušas vēlamo rezultātu. Tas attiecas uz vēža bojājumiem Urīnpūslis, plaušu, olnīcu un citas onkoloģiskās slimības. Būtiskākā kontrindikācija platīna preparātu lietošanai ir smaga nieru mazspēja. Šī iemesla dēļ terapija kļūst mazāk progresīva.
Mūsdienās zāļu Cisplatīna vietā viņi plāno lietot fenantriplatīnu, kas efektīvāk iekļūst vēža skartajās šūnās un kavē transkripciju. Platīna zāļu darbības mehānisms ir citostatisks efekts, kas pilnībā balstās uz garenisko un intraķēdes saišu parādīšanos DNS, veidojot šķēršļus replikācijai. Tas notiek zāļu sastāva dēļ, kuru pamatā ir platīna atoms ar diviem hlora joniem un amonija ligandiem.
Starp visiem smagie metāli, kā pretaudzēju zāles izmanto tikai platīna savienojumus – karboplatīnu un cisplatīnu. Šīs zāles nepieder pie alkilējošām zālēm, jo tās veido krusteniskās saites, kas ir vērtīgākas par DNS. Sīkāk apskatīsim zāles uz platīna bāzes:
Cisplatīns
Pretaudzēju zāles, platīna atvasinājums. Zāles spēj iznīcināt vēža šūnu DNS, izraisot audzēju un metastāžu regresiju. Šo zāļu īpatnība ir tā, ka tās ir neefektīvas, ja tās lieto iekšķīgi. Bet, lietojot intravenozi, zāles ātri un lielās devās nonāk orgānos un sistēmās. Cisplatīns neiekļūst asins-smadzeņu barjerā, un saistīšanās ar asins olbaltumvielām ir 90%. Tas izdalās caur nierēm lēni, pirmajās stundās izdalās apmēram 40% zāļu, pārējais - piecu dienu laikā no ievadīšanas brīža.
- Lietošanas indikācijas. Cisplatīnu lieto gan kompleksā terapijā, kombinācijā ar pretvēža antibiotikām un citām zālēm, gan monoterapijā. Zāles lieto ļaundabīgu olnīcu, urīnpūšļa, sēklinieku, dzemdes kakla vēža, osteogēnas sarkomas un galvas plakanšūnu karcinomas ārstēšanai. Cisplatīns ir efektīvs kā daļa no kompleksās terapijas limfātiskās sistēmas vēža un limfosarkomas ārstēšanā.
- Lietošanas veids. Cisplatīna šķīdumu ievada intravenozi. Ja tiek izmantota monoķīmijterapija, pacientam piecas dienas ievada 20 mg zāļu uz 1 m² ķermeņa virsmas vai 30 mg trīs dienas. Vairāk liela deva 100-150 mg nozīmē zāļu ievadīšanu reizi trīs nedēļās. Intervālam starp kursiem jābūt vismaz trim nedēļām. Kursu skaits tiek noteikts katram pacientam individuāli. Ievadot, 10 mg cisplatīna izšķīdina 10 ml sterila ūdens injekcijām, iegūto šķīdumu atšķaida 1000 ml izotoniskā nātrija hlorīda šķīduma vai 5% glikozes šķīdumā. Zāles ievada strūklā garu infūziju veidā. Lai samazinātu negatīva ietekme uz nierēm, pirms cisplatīna ievadīšanas ieteicams mitrināt pacienta ķermeni.
- Cisplatīns var izraisīt nieru darbības traucējumus, sliktu dūšu, vemšanu, reiboni, apetītes zudumu, dzirdes zudumu vai troksni ausīs. Ir iespējamas alerģiskas reakcijas un straujš leikocītu un trombocītu skaita samazināšanās asinīs. Dažiem pacientiem cisplatīns izraisa neiropātiju, kas ietekmē apakšējo ekstremitāšu nervus. Zāļu ievadīšanas laikā pacients var sajust sāpes gar vēnu.
- Kontrindikācijas. Cisplatīnu nav ieteicams lietot aknu un nieru darbības traucējumu, kaulu smadzeņu hematopoēzes problēmu, kuņģa čūlu, grūtniecības un zāļu individuālas nepanesības gadījumos. Cisplatīns ir kontrindicēts kombinācijā ar zālēm, kas bojā nieres un dzirdes orgānus, kā arī ar streptomicīnu un aminoglikozīdu antibiotikām.
- Zāles ražo injekciju ampulās pa 0,001, 10 gabali iepakojumā. Cisplatīns ir neviendabīgas krāsas dzeltenīga masa, kas viegli sadalās pulverī. Cisplatīns jāuzglabā vietā, kas ir aizsargāta no saules gaismas, temperatūrā, kas nepārsniedz +10 °C. Pieejams tikai pēc receptes.
Karboplatīns
Pretaudzēju līdzeklis, platīna atvasinājumu grupa. Darbības mehānisms ir balstīts uz biosintēzes kavēšanu nukleīnskābes un vēža šūnu nāve. Atšķirībā no cisplatīna, karboplatīnam ir minimāla kaitīga ietekme uz nierēm, ototoksicitāte un neirotoksicitāte.
- Lietošanas indikācijas. Karboplatīnu ordinē pacientiem ar olnīcu, sēklinieku, seminomu, melanomu, dzemdes kakla vēzi, urīnpūšļa vēzi, osteogēnu sarkomu, kakla un galvas audzējiem.
- Zāles lieto tikai intravenozi. Pieaugušiem pacientiem 20-60 minūšu laikā ievada 400 mg uz 1 m² ķermeņa virsmas. Zāles ievada ar mēneša pārtraukumu. Karboplatīns ir izšķīdināts sterils ūdens injekcijām: 5% glikozes šķīdums vai izotonisks nātrija hlorīda šķīdums. Sagatavotā šķīduma derīguma termiņš ir 8 stundas. Karboplatīnu neizmanto vienlaikus ar zālēm, kurām ir nefrotoksiska un neirotoksiska iedarbība. Šīs platīna ķīmijterapijas zāles lieto tikai ārsta uzraudzībā. Pirms ārstēšanas kursa pacientam tiek veikta nieru darbības pārbaude un neiroloģiska izmeklēšana. Zāles ievada, izmantojot komplektus un intravenozas adatas ar alumīnija elementiem.
- Karboplatīns izraisa blakusparādības, kas izpaužas kā hematopoētiskās funkcijas kavēšana, trombocītu un leikocītu skaita samazināšanās asinīs, hemoglobīna līmeņa pazemināšanās asinīs, kreatīna un urīnvielas līmeņa paaugstināšanās asinīs. Zāles izraisa sliktu dūšu, vemšanu, alerģiskas ādas reakcijas, dzirdes zudumu, perifēro nervu bojājumus, jušanas traucējumus un muskuļu vājumu. Karboplatīna lietošanas dēļ pacientiem var rasties daļēja vai pilnīga matu izkrišana, drebuļi un hipertermija.
- Platīna preparāts ir kontrindicēts lietošanai pacientiem ar smagiem nieru darbības traucējumiem un paaugstinātu jutību pret platīna preparātiem. Tā kā zālēm var būt kancerogēna iedarbība, tas ir, izraisīt vēzi, personālam, kas strādā ar karboplatīnu, jābūt īpaši uzmanīgiem.
- Karboplatīnu ražo flakonos kā sterilu liofilizētu pulveri injekcijām. Zāles ir pieejamas 0,05, 0,15, 0,2 un 0,45 g devās pudelēs. Karboplatīns ir pieejams arī injekciju šķīduma veidā 5, 15 un 45 ml ampulās.
Fenantriplatīns
Jauns eksperimentāls pretvēža līdzeklis. Šīs zāles ir izrādījušās efektīvākas par cisplatīnu. Fenantriplatīns pilnībā iznīcina vēža šūnas un novērš rezistences veidošanos pret platīna zālēm. Turklāt šīs zāles aptver plašāku vēža slimību klāstu.
Fenantriplatīnam ir vairākas priekšrocības salīdzinājumā ar cisplatīnu. Zāles vieglāk un ātrāk iekļūst vēža šūnās un kavē transkripciju, tas ir, pārvērš DNS par RNS. Zāļu pētījumā tika izmantoti vairāk nekā 60 vēža šūnu veidi. Ir pierādīts, ka fenantriplatīns ir 40 reizes efektīvāks par cisplatīnu cīņā pret vēža šūnām. Tā kā vēža šūnas var attīstīt rezistenci pret zālēm, fenantriplatīns satur trīs locekļu gredzenu, kas aizsargā platīna zāles no ārējiem uzbrukumiem.
Līdz šim zāles ir apstiprinājušas savu efektivitāti eksperimentos, kas veikti laboratorijās. Tagad fenantriplatīns ir jātestē uz dzīvniekiem, lai apstiprinātu tā pretvēža iedarbību.
Zāles aknām pēc ķīmijterapijas
Zāles aknām pēc ķīmijterapijas ļauj atjaunot skarto orgānu. Aknas jāārstē obligāts, jo ķīmijterapijas laikā orgāns tiek pakļauts spēcīgam smago elementu un toksīnu uzbrukumam, kas tiek izvadīti ilgā laika periodā. Aknas veic vairākas funkcijas. Orgāns aktīvi piedalās vielmaiņā, nodrošina aizsardzības funkcija, neitralizējot toksiskos elementus, un ar žulti izvada no organisma dažādas vielas, veicot izvadīšanas funkciju. Ķīmijterapijas laikā orgāns uzņemas papildu funkcijas. Aknas pārvērš lielāko daļu medikamentu to aktīvajā formā, samazinot to toksisko iedarbību. Aknu stāvoklis ietekmē terapijas efektivitāti. Tādējādi orgānu slimībām ir toksiska un terapeitiska iedarbība uz zālēm. Visas lietotās ķīmijterapijas zāles bojā aknas.
Pēc ķīmijterapijas kursa aknas joprojām nes milzīgs spiediens. Tā kā orgānam ir jāsamazina zāļu toksicitāte. Tas ir, aknas ir jāaizsargā, jāatbalsta un jāatjauno. Pirms ķīmijterapijas kursa onkologs paņem pacientam bioķīmisko asins analīzi. Tas ir saistīts ar faktu, ka daudzi medikamenti negatīvi ietekmē orgānu un var pat mainīt tā struktūru. Dažas ķīmijterapijas zāles darbojas kā tiešas aknu indes, taču to iedarbība ir paredzama. Tāpēc ārsta uzdevums ir savlaicīgi izrakstīt zāles aknu atjaunošanai pēc ķīmijterapijas. Jebkurā gadījumā aknu disfunkcijas pakāpe ir neparedzama un ir atkarīga ne tikai no ķīmisko zāļu devas, bet arī no pacienta ķermeņa individuālajām īpašībām.
Ķīmijterapijas izraisītu aknu mazspēju nav grūti noteikt, galvenais ir savlaicīgi pievērst uzmanību tādiem simptomiem kā:
- Ādas dzeltenums, acu un mutes gļotādas.
- Uz ādas parādās asinsizplūdumi un zirnekļa vēnas.
- Veicot bioķīmisko analīzi, ārsti atzīmē dažādas izmaiņas asinīs.
Sākotnējo bojājuma pakāpi var noteikt tikai ar bioķīmisko asins analīzi. Tāpēc pirms katra ķīmijterapijas kursa pacienta asinīs tiek pārbaudīts enzīmu un bilirubīna līmenis. Lietojot ļoti toksiskas ķīmiskas vielas, aknas sāk aizsargāties jau no pirmajām ārstēšanas dienām.
B vitamīni ir viegli atjaunojoši aknu aizsargi.B12 vitamīns (kalcija pangamāts) tiek nozīmēts visā ķīmijterapijas laikā. Zāles lieto 2 tabletes 3 reizes dienā. Zāles Karsil ir augstas atjaunojošas un aizsargājošas īpašības. Zāles lieto 1 tableti 3 reizes dienā. Multivitamīnu kompleksi ir vēl viena aknu aizsardzība. Iepriekš aprakstītās zāles tiek parakstītas arī tiem vēža pacientiem, kuri slimojuši ar dzelti vai slimojuši vai slimo ar hronisku alkoholismu.
Ja pirms nākamā ķīmijterapijas kursa vai ārstēšanas laikā pacientam tiek konstatēts aknu bojājums, tad pacientam tiek nozīmēts Essentiale. Šīs zāles ir tik populāras, ka tās slava pārsniedz tā efektivitāti un ārstnieciskās īpašības. Zāles jālieto 2-4 mēnešus, un, lai iegūtu ātru efektu, zāles ievada intravenozi 5-10 injekciju veidā. Zāles aknu atjaunošanai pēc ķīmijterapijas sauc par hepatoprotektīviem līdzekļiem, apskatīsim visefektīvākos no tiem:
Karsils
Zāles, ko lieto aknu atjaunošanai pēc ķīmijterapijas kursa. Zāļu aktīvās vielas membrānu stabilizējošā iedarbība samazina agresīvo toksisko vielu kaitīgo ietekmi uz hepatocītiem un samazina aknu šūnu bojājumus. Zāles ir antioksidanta īpašības un optimizē vielmaiņu šūnu līmenī. Aktīvā viela Karsil ir silimarīns, uzlabo pacienta vispārējo stāvokli (apetīti, gremošanas procesus) un normalizē klīniskos testus. Zāles parasti izdalās caur nierēm.
- Galvenās indikācijas zāļu lietošanai ir aknu ciroze, kā arī hronisks vīrusu un toksiskas etioloģijas hepatīts. Karsil ir efektīvs aknu atjaunošanā pēc ķīmijterapijas kursa un slimībām ar aknu komplikācijām.
- Zāles lieto 1 līdz 4 reizes dienā atkarībā no organisma individuālajām vajadzībām un slimības smaguma pakāpes. Šajā gadījumā ārstēšanas kursam jābūt vismaz 90 dienām.
- Karsil blakusparādības izpaužas kā dispepsija, vestibulārie traucējumi un alopēcija. Iepriekš minētie simptomi izzūd paši pēc zāļu lietošanas pārtraukšanas.
- Karsil ir kontrindicēts individuālas nepanesības gadījumā pret zāļu sastāvdaļām vai alerģiskām reakcijām pret zāļu sastāvdaļām. Karsil var kombinēt ar citām zālēm, jo nav pierādījumu par nelabvēlīgu mijiedarbību.
- Zāļu pārdozēšanas gadījumā var rasties vemšana un slikta dūša. Lai novērstu nelabvēlīgus simptomus, nepieciešams izskalot kuņģi, veikt simptomātiska terapija un ņem sorbentus.
- Karsil ir pieejams tablešu veidā. Zāles jāuzglabā bērniem nepieejamā vietā un prom no saules gaismas. Uzglabāšanas temperatūra nedrīkst pārsniegt 16-25 grādus. Zāles tiek izsniegtas aptiekās bez ārsta receptes.
Essentiale
Efektīva aknu zāles ar aktīvās vielas būtiski fosfolipīdi. Aktīvās vielas aktīvi piedalās reģenerācijā, diferenciācijā un šūnu dalīšanā. Pateicoties tam, zāles regulē šūnu membrānas caurlaidību un uzlabo membrānas darbību. Essentiale farmakoloģisko īpašību mērķis ir atjaunot bojātas šūnas aknas, uzlabo aknu detoksikācijas funkciju, normalizē to darbību.
- Galvenās indikācijas zāļu lietošanai ir akūts un hronisks hepatīts, aknu šūnu nekroze un ciroze, toksiski bojājumi, prekoma un aknu koma, tauku deģenerācija, ārstēšana pirms un pēc operācijas. Zāles ir efektīvas neirodermīta, radiācijas sindroma un psoriāzes gadījumā.
- Essentiale tiek ražots kapsulu un injekciju veidā intravenozai ievadīšanai. Kapsulas lieto trīs reizes dienā, pa diviem gabaliem, kā uzturošo terapiju. Kas attiecas uz intravenozas injekcijas, tad zāles ievada lēni, no 5 ml dienā līdz 20 ml smagos gadījumos. Vienā reizē ir atļauts ievadīt ne vairāk kā 10 ml zāļu. Injekcijas veic 10 dienas, pēc tam ieteicams turpināt parenterālu terapiju ar Essentiale kapsulām. Ārstēšanas kurss ilgst no 3 līdz 6 mēnešiem.
- Pārdozēšanas gadījumā parādās zāļu negatīvie simptomi. Essentiale zvani kuņģa-zarnu trakta traucējumi un slikta dūša. Ārstēšana ir simptomātiska. Essentiale ir kontrindicēts lietošanai pacientiem ar paaugstinātu jutību pret zāļu sastāvdaļām. ], [
- Galvenās indikācijas zāļu lietošanai: akūts, hronisks hepatīts un hepatoze, alkohola steatoze, saindēšanās ar toksīniem, rūpnieciskās un medicīniskās indes. Aknu ārstēšana un atjaunošana pēc ķīmijterapijas un slikta uztura. Enerliv nodrošina pozitīva ietekme ja nemedikamentozās aknu atjaunošanas metodes ir neefektīvas.
- Zāles lieto divas kapsulas trīs reizes dienā, mazgā ar lielu daudzumu ūdens. Zāļu lietošanas ilgumu katram pacientam izvēlas ārsts individuāli.
- Enerliv blakusparādības izpaužas kā kuņģa-zarnu trakta traucējumi, caureja un sāpes epigastrālajā reģionā. Retos gadījumos zāles izraisa alerģiskas reakcijas (izsitumus, nātreni, eksantēmu) un asiņošanu (asiņošanu starpmenstruālā periodā, petehiālus izsitumus).
- Enerliv ir kontrindicēts, ja ir individuāla nepanesība pret zāļu sastāvdaļām, alerģija pret soju un zemesriekstiem vai antifosfolīdu sindroms anamnēzē. Ja zāles mijiedarbojas ar kumarīna antikoagulantiem, ieteicams pielāgot zāļu devas, jo iespējama darbības sinerģija.
Papildus iepriekš aprakstītajām zālēm aknu atjaunošanai pēc ķīmijterapijas diētai ir orgānu reģenerējošas un ķermenim ārstnieciskas īpašības. Diētiskā uzturs ietver izvairīšanos no ceptiem, sautētiem, taukainiem un saldiem ēdieniem. Aizliegts taukainas šķirnes zivis un gaļa, kūpināta gaļa, marinēti gurķi, desa un citi pārtikas produkti, kas bagāti ar holesterīnu. Aknu atveseļošanās periodā ir stingri aizliegts lietot sēnes, rāceņus, pupiņas, zirņus, spinātus, sīpolus un aukstos dzērienus.
Uztura speciālisti un ārsti koncentrējas uz veģetāro diētu. Pacientam ieteicams ēst dārzeņu ēdienus un zupas, piena produktus. Tvaicēti gaļas ēdieni, liesa vārīta gaļa, liesa zivs. Ir atļauts ēst zema tauku satura biezpienu ar medu, pienu un piena produktiem, kā arī maigus sierus. Jebkuru aknu bojājumu gadījumā, īpaši atveseļošanās periods, uzturā jāiekļauj nogatavojušās ogas, augļi, žāvēti augļi, augļu un ogu sulas, novārījumi un kviešu klijas. Šajā gadījumā ikdienas uzturā vajadzētu būt 90 g olbaltumvielu, 80 g tauku un 400 g ogļhidrātu. Tas ir, ikdienas kaloriju saturs nedrīkst pārsniegt 3000 kcal.
],
